题目内容
CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是

A.该反应为吸热反应
B.CO(g)和H2O(g)具有的总能量大于CO2(g)和H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g) 要放出41 kJ热量
B
【解析】
试题分析:A.该反应反应物的能量高于生成物的能量,为放热反应,错误;B.正确;C.CO与水蒸气的反应需在高温下进行,错误;D. 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g) 要吸收41 kJ热量,错误;选B。
考点:考查化学反应能量变化的图像。

(16分)
化学式 | NH3·H2O | HCN | CH3COOH | H2CO3 |
电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
(1)电离平衡常数是衡量弱电解质电离程度强弱的量。上表中给出几种弱电解质的电离平衡常数,从中可以判断:在相同温度下,同浓度的三种酸溶液的导电能力由大到小的顺序为 。
(2)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,三种溶液的pH由大到小的顺序为 。(填溶液前序号)
②浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-) c(K+)-c(CH3COO-)。(填“>”、“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈 性(填“酸”、“碱”或“中”),用离子方程式表示原因 。
④室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质是 。
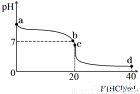
⑤NH4HCO3溶液呈 性(填“酸”、“碱”或 “中”)。
(3)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式 。

 C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
 CO (g)+H2O(g) △H>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是
CO (g)+H2O(g) △H>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是
 等结合成的。如果某烷分子中同时存在这4种基团,所含碳原子数最小,这种烷烃分子应含 个碳原子,其结构简式可能为 或 或 。
等结合成的。如果某烷分子中同时存在这4种基团,所含碳原子数最小,这种烷烃分子应含 个碳原子,其结构简式可能为 或 或 。