题目内容
已知A、B两元素原子的电子构型分别为:1s22s22p2、1s22s22p63s23p5,则由A、B两元素形成的稳定化合物为( )
分析:根据价层电子数确定对应的最高正价和最低负价,可确定化合物的化学式.
解答:解:A的电子构型为1s22s22p2,原子核外最外层电子数为4,最高化合价为+4价,B的电子构型为1s22s22p63s23p5,最外层电子数为7,最低化合价为-1价,则形成的化合物为AB4,
故选C.
故选C.
点评:本题考查原子核外电子排布,题目难度不大,注意根据最外层电子数确定化合价为解答该题的关键.

练习册系列答案
相关题目
(10分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,乙的电子式为 ,丙的电子式为 ,B的最高价氧化物的水化物的化学式为 。
③向甲的水溶液中加入,反应的化学方程式为 。
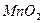 ,反应的化学方程式为 。
,反应的化学方程式为 。