题目内容
 以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:
以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:
试回答下列问题:
(1)已知反应Ⅰ中有Na2S生成,该反应的化学方程式为______.
(2)配平反应Ⅱ的化学方程式:______Na2S+______Na2CO3+______SO2=______Na2S2O3+______CO2
(3)反应Ⅲ温度需控制在35~40℃的较低温度,其主要原因是______.
(4)在摩尔盐溶液中加入一种物质的溶液可使NH4+、Fe2+、SO42-都大量减少,该物质是______.
(5)反应Ⅳ后,一般在酸性条件下结晶出摩尔盐,但如果该操作时间过长,摩尔盐中会因氧化而混有杂质,用离子方程式说明原因______.
解:(1)反应物为Na2SO4和C,生成物为Na2S和CO,则1molNa2SO4和4molC反应,转移电子数目相等,则反应的化学方程式为Na2SO4+4C=Na2S+4CO,
故答案为:Na2SO4+4C=Na2S+4CO;
(2)根据氧化剂与还原剂得失电子数目相等,则有Na2S~2SO2,结合元素质量守恒,可写出化学方程式为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,
故答案为:2;1;4;3;1;
(3)NH4HCO3在高温下易分解,反应Ⅲ温度需控制在35~40℃的较低温度,以提高NH4HCO3利用率和NaHCO3产率,
故答案为:防止NH4HCO3分解,提高NH4HCO3利用率和NaHCO3产率;
(4)NH4+、Fe2+易与OH-反应,SO42-与Ba2+反应生成沉淀而减少,则应加入Ba(OH)2,
故答案为:Ba(OH)2;
(5)摩尔盐中含有Fe2+离子,具有还原性,易被O2氧化,反应的离子方程式为4Fe2++4H++O2═4Fe3++2H2O,
故答案为:4Fe2++4H++O2═4Fe3++2H2O.
分析:(1)根据反应物和生成物结合质量守恒以及氧化还原反应得失电子守恒书写化学方程式;
(2)根据氧化还原反应中氧化剂和还原剂得失电子守恒结合质量守恒定律配平反应的化学方程式;
(3)NH4HCO3在高温下易分解;
(4)NH4+、Fe2+易与OH-反应,SO42-与Ba2+反应生成沉淀而减少;
(5)摩尔盐中含有Fe2+离子,具有还原性,易被O2氧化.
点评:本题考查较为综合,设计氧化还原反应、离子反应等问题,题目难度中等,注意氧化还原反应的配平.
故答案为:Na2SO4+4C=Na2S+4CO;
(2)根据氧化剂与还原剂得失电子数目相等,则有Na2S~2SO2,结合元素质量守恒,可写出化学方程式为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,
故答案为:2;1;4;3;1;
(3)NH4HCO3在高温下易分解,反应Ⅲ温度需控制在35~40℃的较低温度,以提高NH4HCO3利用率和NaHCO3产率,
故答案为:防止NH4HCO3分解,提高NH4HCO3利用率和NaHCO3产率;
(4)NH4+、Fe2+易与OH-反应,SO42-与Ba2+反应生成沉淀而减少,则应加入Ba(OH)2,
故答案为:Ba(OH)2;
(5)摩尔盐中含有Fe2+离子,具有还原性,易被O2氧化,反应的离子方程式为4Fe2++4H++O2═4Fe3++2H2O,
故答案为:4Fe2++4H++O2═4Fe3++2H2O.
分析:(1)根据反应物和生成物结合质量守恒以及氧化还原反应得失电子守恒书写化学方程式;
(2)根据氧化还原反应中氧化剂和还原剂得失电子守恒结合质量守恒定律配平反应的化学方程式;
(3)NH4HCO3在高温下易分解;
(4)NH4+、Fe2+易与OH-反应,SO42-与Ba2+反应生成沉淀而减少;
(5)摩尔盐中含有Fe2+离子,具有还原性,易被O2氧化.
点评:本题考查较为综合,设计氧化还原反应、离子反应等问题,题目难度中等,注意氧化还原反应的配平.

练习册系列答案
相关题目
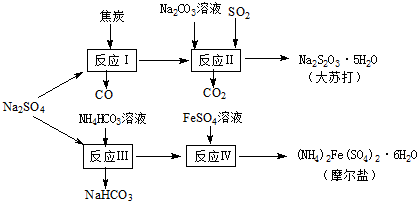 以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下:
以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高.其主要流程如下: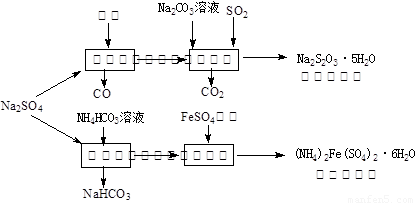
 都大量减少,该物质是 。
都大量减少,该物质是 。