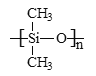题目内容
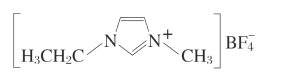
【题目】离子液体由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。如图为某离子液体的结构,回答下列问题:
(1)基态N原子的价电子排布图为______。![]() 中,B原子杂化方式为______,与
中,B原子杂化方式为______,与![]() 互为等电子体的含氧酸根离子是______(写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是_____,它们性质相似的原因是_____。
互为等电子体的含氧酸根离子是______(写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是_____,它们性质相似的原因是_____。
(2)NH3极易溶于水的原因与氢键有关,用“…”表示氢键,结合NH3·H2O的电离推测NH3·H2O可能结构式为_____。
(3)离子液体是在室温和室温附近温度下呈液态的盐类物质。该离子液体常温下为液体,而NaBF4常温下为固体,其原因是_____。
(4)分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则该离子液体的阳离子中存在的一个大
),则该离子液体的阳离子中存在的一个大![]() 键可表示为_____。
键可表示为_____。
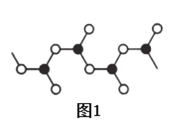
(5)某硼的含氧酸根离子为无限链状结构,节选部分结构如图1所示,其离子的化学式可用通式表示为_____(用n代表B原子数)。
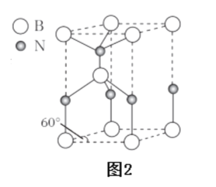
(6)某种含B和N两种元素的功能陶瓷,其晶胞结构如图2所示。已知该晶胞底面为菱形,其底边长为acm,高为bcm,晶体密度为_____g·cm-3(列出含有a,b,NA的计算式即可)。
【答案】 sp3
sp3 ![]() Si 电负性相近
Si 电负性相近  二者均为离子晶体,NaBH4晶格能大 π56 (BO2)nn—或(BnO2n) n—(其他合理答案也可)
二者均为离子晶体,NaBH4晶格能大 π56 (BO2)nn—或(BnO2n) n—(其他合理答案也可) ![]() 或
或![]()
【解析】
(1)N原子核外价电子数为5,电子排布式为2s22p3;BF4-中B原子的价层电子对数为4;原子个数和价电子数相等的微粒互为等电子体B和Si电负性相近,性质相似;
(2)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,由一水合氨可电离出NH4+和OH-可知,一水合氨中氨分子中的N原子与水分子中的氢原子形成氢键;
NH4++OH-,由一水合氨可电离出NH4+和OH-可知,一水合氨中氨分子中的N原子与水分子中的氢原子形成氢键;
(3)离子晶体的晶格能越大,熔沸点越高;
(4) 的环中的大π键由3个碳原子和2个氮原子形成,每个碳原子有1个电子、每个氮原子有2个电子形成大π键,由于环带一个单位正电荷,则共有6个电子形成大π键;
的环中的大π键由3个碳原子和2个氮原子形成,每个碳原子有1个电子、每个氮原子有2个电子形成大π键,由于环带一个单位正电荷,则共有6个电子形成大π键;
(5)由均摊法和满足O原子的8电子稳定结构推断可得;
(6)由均摊法计算可得。
(1)N原子核外价电子数为5,电子排布式为2s22p3,则价电子排布图为 ;BF4-中B原子的价层电子对数为4,则B原子杂化方式为sp3杂化;原子个数和价电子数相等的微粒互为等电子体,含氧酸根SO42—和BF4-的原子个数都为5,价电子数都为32,互为等电子体;B的电负性为2.04,Si的电负性为1.90,B和Si电负性相近,性质相似,故答案为:
;BF4-中B原子的价层电子对数为4,则B原子杂化方式为sp3杂化;原子个数和价电子数相等的微粒互为等电子体,含氧酸根SO42—和BF4-的原子个数都为5,价电子数都为32,互为等电子体;B的电负性为2.04,Si的电负性为1.90,B和Si电负性相近,性质相似,故答案为: ;sp3;SO42—;Si;电负性相近;
;sp3;SO42—;Si;电负性相近;
(2)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,由一水合氨可电离出NH4+和OH-可知,一水合氨中氨分子中的N原子与水分子中的氢原子形成氢键,结构式为
NH4++OH-,由一水合氨可电离出NH4+和OH-可知,一水合氨中氨分子中的N原子与水分子中的氢原子形成氢键,结构式为 ,故答案为:
,故答案为: ;
;
(3)离子晶体的晶格能越大,熔沸点越高,离子液体 和NaBF4都是离子化合物,由于NaBF4的晶格能大于离子液体,所以常温下,离子液体
和NaBF4都是离子化合物,由于NaBF4的晶格能大于离子液体,所以常温下,离子液体 为液体,而NaBF4为固体,故答案为:二者均为离子晶体,NaBH4晶格能大;
为液体,而NaBF4为固体,故答案为:二者均为离子晶体,NaBH4晶格能大;
(4) 的环中的大π键由3个碳原子和2个氮原子形成,每个碳原子有1个电子、每个氮原子有2个电子形成大π键,由于环带一个单位正电荷,则共有6个电子形成大π键,可表示为π56,故答案为:π56;
的环中的大π键由3个碳原子和2个氮原子形成,每个碳原子有1个电子、每个氮原子有2个电子形成大π键,由于环带一个单位正电荷,则共有6个电子形成大π键,可表示为π56,故答案为:π56;
(5)由图可知,黑球表示B原子,白球表示O原子,结构中BO3结构单元通过氧原子连接形成链状结构,则B原子和O原子的数目比1:(2×![]() +1)=1:2,以图中4个B原子为例,要满足O原子的8电子稳定结构,需要带4个单位负电荷,则该离子的化学式可用通式(BO2)nn—或(BnO2n) n—表示,故答案为:(BO2)nn—或(BnO2n) n—;
+1)=1:2,以图中4个B原子为例,要满足O原子的8电子稳定结构,需要带4个单位负电荷,则该离子的化学式可用通式(BO2)nn—或(BnO2n) n—表示,故答案为:(BO2)nn—或(BnO2n) n—;
(6)由图可知,晶胞中B原子的个数为4×![]() +4×
+4×![]() +1=2,N原子个数为2×
+1=2,N原子个数为2×![]() +2×
+2×![]() +1=2,则晶胞的质量为
+1=2,则晶胞的质量为![]() g,由底边长为acm,高为bcm可知,晶胞的体积为a×asin60°×bcm3= sin60°a2bcm3,则晶体密度为
g,由底边长为acm,高为bcm可知,晶胞的体积为a×asin60°×bcm3= sin60°a2bcm3,则晶体密度为![]() =
=![]() g/ cm3=
g/ cm3=![]() g/ cm3,故答案为:
g/ cm3,故答案为:![]() 或
或![]() 。
。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
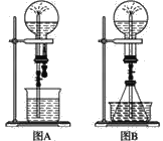
优化作业上海科技文献出版社系列答案【题目】如图所示,利用培养皿探究NH3的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝 | NH3是一种可溶性碱 |
A.AB.BC.CD.D
【题目】探索CO和NO2这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
I.CO可以与H2反应制备合成天然气(SNG)。涉及反应如下:
CO甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)![]() 1=-206.2kJ·mol-1
1=-206.2kJ·mol-1
水煤气变换:CO(g)+H2O(g)CO2(g)+H2(g)![]() 2=-41.2kJ·mol-1
2=-41.2kJ·mol-1
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的![]() =_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
=_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
(2)在恒压管道反应器中将原料气H2和CO按一定比例通入,在催化剂作用下制备合成天然气,400℃、p总为100kPa时反应体系平衡组成如表所示。
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数 | 45.0 | 42.5 | 10.0 | 2.00 | 0.500 |
该条件下CO的总转化率α=______。若将管道反应器升温至500℃,反应达到平衡后CH4的体积分数![]() ______45.0%(填“>”、“<”或“=”)。
______45.0%(填“>”、“<”或“=”)。
II.NO2可发生二聚反应生成N2O4,化学方程式为2NO2![]() N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
(3)已知该反应的正反应速率方程为υ正=k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则右图(lgk表示速率常数的对数;![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随![]() 变化关系的是斜线______,能表示lgk逆随
变化关系的是斜线______,能表示lgk逆随![]() 变化关系的是斜线______。
变化关系的是斜线______。
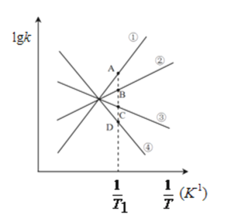
(4)图中A、B、C、D点的纵坐标分别为a+1.5、a+0.5、a-0.5、a-1.5,则T1温度时化学平衡常数K=______mol-1·L。已知T1温度时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol·L-1,此时υ正______υ逆(填>或<);该反应达到平衡后,若将温度从T1升高到T2重新达到平衡,则T1温度时平衡压强p(T1)______T2温度时平衡压强p(T2)(填“>”、“=”或“<”),原因是______。