题目内容
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO﹣、CN﹣、HCO3﹣、N2、Cl﹣六种物质,在反应过程中测得ClO﹣和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
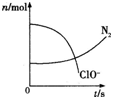
A.还原剂是CN﹣,氧化产物只有N2
B.氧化剂是ClO﹣,还原产物是HCO3﹣
C.配平后氧化剂与还原剂的计量系数之比为5:2
D.标准状况下若生成2.24LN2,则转移电子0.5 mol
【答案】C
【解析】
试题分析:由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为-1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,化合价总共升降最小公倍数为2[(4-2)+(3-0)]=10价,故CN-系数为2,ClO-系数为5,由元素守恒可知HCO3-系数为2,N2系数为1,Cl-系数为5,H2O系数为1,反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-;A.反应中,C元素化合价由CN-中+2价升高为HCO3-中+4价,N元素化合价由CN-中-3价升高为N2中0价,可知CN-为还原剂,氧化产物有HCO3-、N2,故A错误;B.反应中Cl元素化合价由ClO-中+1价降低为Cl-中-1价,ClO-是氧化剂,还原产物是Cl-,故B错误;C.由上述分析可知,反应为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,反应中是CN-是还原剂,ClO-是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,故C正确;D.2.24LN2(标准状况)的物质的量为0.1mol,所以参加反应的ClO-的物质的量为0.5mol,反应中只有氯元素化合价降低,由ClO-中+1价降低为Cl-中-1价,所以转移电子为0.5mol×2mol=1mol,故D错误;故选C。

 阅读快车系列答案
阅读快车系列答案【题目】锰的单质及其化合物在生产、生活中有广泛应用。
(1)碱性锌锰电池广泛应用于日常生活。电池的总反应式为:Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。该电池的正极反应式为 。
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
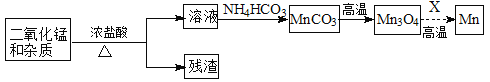
①加入浓盐酸溶解废旧电池内黑色物质过程中保持通风,其原因是 。
②从产品纯度、环保等角度考虑,X宜选择 (填代号)。
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 。
(3)电解硫酸锰溶液法制锰又叫湿法冶锰。以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
![]()
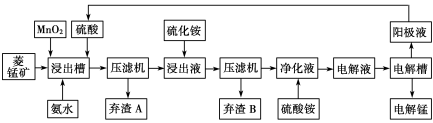
已知:NiS 、CoS均难溶于水。部分氢氧化物的pH如下表:(若某离子浓度小于等于105mol·L1,则认为完全沉淀)
物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
①浸出槽内MnO2的作用是(用离子方程式表示) 。
②加入氨水调节浸出槽中溶液的pH范围为 。
③电解槽阴极的电极反应式为 。
【题目】根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去)。
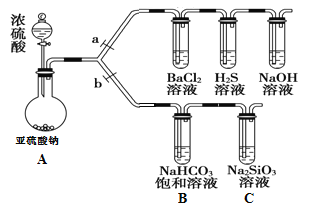
(1)验证SO2的氧化性、还原性和酸性氧化物的通性。
①连接仪器、_______________、加药品后,打开a、关闭b,然后滴入浓硫酸。
②装置A中发生的化学方程式是____________ ___。
③验证SO2的氧化性的实验现象是_____________ __。
④BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
滴加的溶液 | 氨水 | 氯水 |
沉淀的化学式 |
(2)验证碳、硅非金属性的相对强弱。
①在(1)①操作后打开b,关闭a。
②NaHCO3饱和溶液中发生的离子反应方程式为____________ ___。
③实验过程中,C中出现白色沉淀。甲同学认为不能由此说明碳的非金属性比硅强,需增加一个实验装置才能获得可靠实验结论,其改进方法为__________ 。


