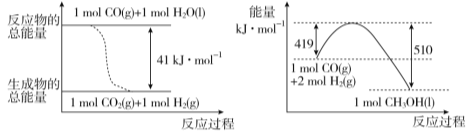
题目内容
【题目】向容积固定为2L的密闭容器中充入9.6mol NO和4.8molO2,发生如下反应:
①2NO(g)+O2(g)![]() 2NO2(g) △H<0
2NO2(g) △H<0
②2NO2(g)![]() N2O4(g) △H<0
N2O4(g) △H<0
测得反应达到平衡时NO2浓度为1.2 mol/L,N2O4的浓度为0.8 mol/L。则反应①的化学平衡常数为( )
A. 0.24 B.0.36 C.1.44 D.l.96
【答案】B
【解析】
试题分析:平衡时NO2浓度为1.2 mol/L,N2O4的浓度为0.8 mol/L。说明反应①中生成c总(NO2)=1.2 mol/L+0.8 mol/L×2=2.8mol/L,反应①中消耗的c(NO)=2.8mol/L,消耗的c(O2)=![]() ×2.8mol/L=1.4mol/L,因此达到平衡后,c(NO)=
×2.8mol/L=1.4mol/L,因此达到平衡后,c(NO)=![]() -2.8mol/L=2mol/L,c(O2)=
-2.8mol/L=2mol/L,c(O2)=![]() -1.4mol/L=1mol/L,c(NO2)=1.2mol/L,则反应①的化学平衡常数K=
-1.4mol/L=1mol/L,c(NO2)=1.2mol/L,则反应①的化学平衡常数K=![]() =0.36,故选B。
=0.36,故选B。

练习册系列答案
相关题目