题目内容
13.根据碱金属的性质变化规律可推测铯的性质,下列推测错误的是( )| A. | 灼烧CsCl时,火焰有特殊的颜色 | |
| B. | CsNO3易溶于水 | |
| C. | 在钠、钾、铯三种单质中,钠的熔点最低 | |
| D. | CsOH是弱碱 |
分析 A.碱金属元素的焰色反应呈现特殊的颜色;
B.依据硝酸盐都易溶于水的性质;
C.碱金属单质熔沸点从上到下依次降低;
D.碱金属金属性从上到下依次性增强,最高价氧化物对应水化物的碱性依次增强.
解答 解:A.碱金属元素的焰色反应均会呈现特殊的颜色,故A正确;
B.硝酸盐都易溶于水,所以硝酸铯易溶于水,故B正确;
C.碱金属单质熔沸点从上到下依次降低,钠、钾、铯三种单质中,钠的熔点最高,故C错误;
D.碱金属金属性从上到下依次性增强,最高价氧化物对应水化物的碱性依次增强,铯在钠、钾的下方,氢氧化钠、氢氧化钾都是强碱,所以CsOH是强碱,故D错误;
故选:CD.
点评 本题考查了碱金属的性质,明确碱金属性质的递变规律是解题关键,题目难度不大.

练习册系列答案
相关题目
1.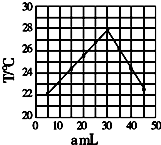 将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )
将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )
 将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )
将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )| A. | 做该实验时,环境温度为22摄氏度 | |
| B. | 该实验表明化学能可能转化为热能 | |
| C. | NaOH溶液的浓度约为0.1mol/L | |
| D. | 该实验表明有水生成的反应都是放热反应 |
8.合乎实际并用于工业生产的是( )
| A. | 金属钠在氯气中燃烧制氯化钠 | B. | 氢气和氯气混合经光照制氯化氢 | ||
| C. | 氯气通入澄清石灰水中制漂白粉 | D. | 高温分解石灰石制生石灰 |
5.已知水的电离平衡曲线如图,下列说法正确的是( )
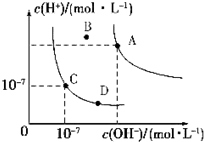

| A. | 水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D) | |
| B. | B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7 | |
| C. | 向水中加入醋酸钠固体,可从C点到D点 | |
| D. | 升高温度可实现由C点到D点 |
2.下列叙述正确的是( )
| A. | 40 K和40 Ca原子中的质子数和中子数都相等 | |
| B. | 某元素最外层只有一个电子,则它一定是ⅠA族元素 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |
20.与Na+具有相同的质子数和电子数的微粒是( )
| A. | CH4 | B. | H3O+ | C. | NH2- | D. | F- |
 NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。 .
.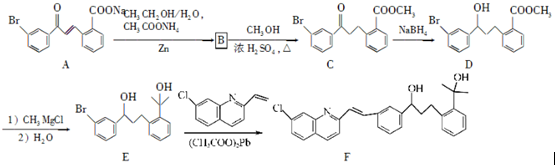 请回答下列问题:
请回答下列问题: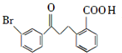 .
.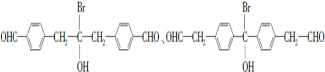 .
. 为原料制备
为原料制备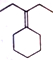 的合成路线流程图(乙醚溶剂及无机试剂任用)
的合成路线流程图(乙醚溶剂及无机试剂任用)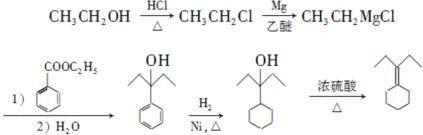 ;
;