题目内容
“生物质”是指由植物或动物生命体衍生得到的物质的总称.“生物质能”是人类解决能源危机的一种重要的能源.“生物质”在一定条件下可气化为CO、H2等原料气,进而合成甲醇和二甲醚(CH3OCH3),相关反应为:
①2H2(g)+CO(g)?CH3OH(g);
②4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g).
请根据图1、2示回答问题:
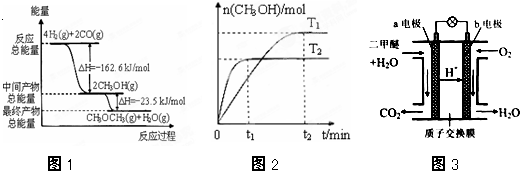
(1)由H2和CO合成二甲醚的热化学方程式是 .
(2)在T1、T2温度下,向两个容积相同的密闭容器中分别通入1molCO和2molH2合成甲醇,则T1、T2温度下对应反应的平衡常数K1 K2(选填“>”、“<”或“=”).
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3 (g)和1molH2O(g),经一定时间反应②达到平衡状态,此时测得混合气体密度是相同条件下起始时的1.6倍.反应开始时正、逆反应速率的大小关系为υ正 υ逆(选填“>”、“<”或“=”),平衡时n(CH3OCH3)= mol.
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图.
(a、b均为多孔性Pt电极).
a电极是 极(填“正”或“负”);
b电极上的电极反应为 .
①2H2(g)+CO(g)?CH3OH(g);
②4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g).
请根据图1、2示回答问题:
(1)由H2和CO合成二甲醚的热化学方程式是
(2)在T1、T2温度下,向两个容积相同的密闭容器中分别通入1molCO和2molH2合成甲醇,则T1、T2温度下对应反应的平衡常数K1
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3 (g)和1molH2O(g),经一定时间反应②达到平衡状态,此时测得混合气体密度是相同条件下起始时的1.6倍.反应开始时正、逆反应速率的大小关系为υ正
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图.
(a、b均为多孔性Pt电极).
a电极是
b电极上的电极反应为

考点:热化学方程式,化学电源新型电池,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)依据图象分析书写热化学方程式,根据盖斯定律计算所需热化学方程式;
(2)图象分析,先拐先平的分析方法可知T1<T2,依据化学平衡移动原理分析判断;
(3)反应前后气体总质量不变;用差量法解题,方程式中3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)减少了4mol;
(4)氧气得电子,化合价降低,故b电极是正极;由图知在a电极二甲醚与水反应生成二氧化碳和氢离子,故a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+;
(2)图象分析,先拐先平的分析方法可知T1<T2,依据化学平衡移动原理分析判断;
(3)反应前后气体总质量不变;用差量法解题,方程式中3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)减少了4mol;
(4)氧气得电子,化合价降低,故b电极是正极;由图知在a电极二甲醚与水反应生成二氧化碳和氢离子,故a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+;
解答:
解:(1)图象分析可知反应的热化学方程式为 ①4H2(g)+2CO(g)=2CH3OH(g);△H=-162.6kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ?mol-1
由盖斯定律①+②得到:4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g)△H=-186.1KJ/mol,
故答案为:4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g)△H=-186.1KJ/mol;
(2)图象分析可知T1<T2,温度越高甲醇物质的量越小,说明升温平衡逆向进行,正反应为放热反应,2H2(g)+CO(g)?CH3OH(g),则T1、T2温度下对应反应的平衡常数K1>K2,故答案为:>;
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小,平衡正向进行,正反应速率大于逆反应速率;平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的0.625倍,总物质的量=8×0.625=5mol,反应前后减少了3mol,设反应生成甲醚xmol,
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)减少了4mol,
1 4
x 3
解得:x=0.75mol平衡时,n(CH3OCH3)=1+0.75=1.75mol,
故答案为:>;1.75;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,氧气在正极放电,b电极为正极,由图可知,a极为负极,二甲醚放电生成二氧化碳,由离子交换膜可知还生成氢离子,a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+,b电极上的反应为:O2+4H++4e-═2H2O,故答案为:负;O2+4H++4e-═2H2O.
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ?mol-1
由盖斯定律①+②得到:4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g)△H=-186.1KJ/mol,
故答案为:4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g)△H=-186.1KJ/mol;
(2)图象分析可知T1<T2,温度越高甲醇物质的量越小,说明升温平衡逆向进行,正反应为放热反应,2H2(g)+CO(g)?CH3OH(g),则T1、T2温度下对应反应的平衡常数K1>K2,故答案为:>;
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小,平衡正向进行,正反应速率大于逆反应速率;平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的0.625倍,总物质的量=8×0.625=5mol,反应前后减少了3mol,设反应生成甲醚xmol,
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)减少了4mol,
1 4
x 3
解得:x=0.75mol平衡时,n(CH3OCH3)=1+0.75=1.75mol,
故答案为:>;1.75;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,氧气在正极放电,b电极为正极,由图可知,a极为负极,二甲醚放电生成二氧化碳,由离子交换膜可知还生成氢离子,a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+,b电极上的反应为:O2+4H++4e-═2H2O,故答案为:负;O2+4H++4e-═2H2O.
点评:本题考查影响平衡的因素、化学平衡常数、化学平衡图象、反应热的计算原电池原理应用等综合性强,难度中等.

练习册系列答案
相关题目
下列反应属于氧化还原反应的是( )
| A、石灰石在高温下的分解反应 |
| B、生石灰和水的反应 |
| C、盐酸与氢氧化钠溶液的反应 |
| D、木炭在氧气中燃烧 |
反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后,水蒸气的物质的量增加了4.5mol,则此反应的平均速率
(X)(反应物的消耗速率或产物的生成速率)可表示为( )
. |
| v |
| A、v(NH3)=0.01mol/(L?s) |
| B、v(O2)=0.03mol/(L?s) |
| C、v(NO)=0.02mol/(L?s) |
| D、v(H2O)=0.04mol/(L?s) |
某温度下,在一固定体积的密闭容器中,进行如下化学反应:H2(g)+I2(g)?2HI(g).下列情
况能说明该反应一定达到平衡的是( )
况能说明该反应一定达到平衡的是( )
| A、混合气体的颜色不再改变的状态 |
| B、混合气体的压强不再改变的状态 |
| C、单位时间内拆开1mol H-H键,同时拆开1mol H-I键 |
| D、混合气体的密度不再改变的状态 |
 和
和 D、35Cl和37Cl E、乙醇和乙二醇
D、35Cl和37Cl E、乙醇和乙二醇