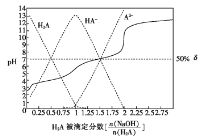
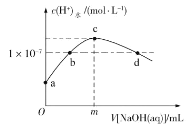
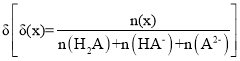题目内容
【题目】铜和镁的合金4.8g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为()
A.8.71gB.8.455g
C.8.51gD.7.04g
【答案】A
【解析】
4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况)的物质的量分别为![]() 和
和![]() ,根据电子转移守恒,金属失去的电子等于硝酸转化为NO2和N2O4时得到的电子,有金属失去电子物质的量为0.2mol×1+0.015mol×2×1=0.23mol。最终生成沉淀为Cu(OH)2和Mg(OH)2,根据电荷守恒可知,金属失去电子物质的量等于沉淀中氢氧根的物质的量,故沉淀质量为4.8g+0.23mol×17g/mol=8.71g;
,根据电子转移守恒,金属失去的电子等于硝酸转化为NO2和N2O4时得到的电子,有金属失去电子物质的量为0.2mol×1+0.015mol×2×1=0.23mol。最终生成沉淀为Cu(OH)2和Mg(OH)2,根据电荷守恒可知,金属失去电子物质的量等于沉淀中氢氧根的物质的量,故沉淀质量为4.8g+0.23mol×17g/mol=8.71g;
答案选A。

练习册系列答案
相关题目
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
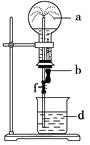
|
| |
A. |
| 水 |
B. |
| 4mol/LNaHSO3溶液 |
C. | Cl2 | 饱和NaCl水溶液 |
D. |
| 1mol/L盐酸 |
A.AB.BC.CD.D