题目内容
根据①碳原子的电子层结构和每两个原子之间方能形成共用电子对而成为共价键;②烃分子中,每减少两个氢原子会减少两根碳氢键而增加一根碳碳键;③把一对共用电子对作为一根键,碳碳双键则为两根键……,苯环用凯库勒式作讨论,碳原子数用n表示。
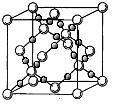
(1)已知碳的一种同素异形体富勒烯C60。有六十个碳原子构成,则该物质分子中共有共用电子对数为________。
(2)那么烷烃CnH2n+2中含碳碳键________根,含共价键总数为________。
(3)炔烃中有共价键数________,其发生某一反应后产物中含有共价键3n根,则发生的反应是
A.与H2 1:1加成 B.与氯气发生1:2加成
C.与H2P 1:1加成 D.一定数目分子加聚成环状化合物
(4)某烃分子中含有碳碳键数为n+3,则该烃可能为
A.环烷烃 B.稠环芳香径 C.苯及其同系物 D.二炔烃
120 n-1 3n+1 3n-1 A CD
本题考查有机物的结构。(1)每个碳原子形成4个共价键,每个共价键被2个碳原子共用,所以60个碳原子形成共价键的数目为60×2=120;(2)烷烃中碳与碳之间都是单键,n个碳原子形成n-1个碳碳单键,而一个氢原子可以形成一个碳氢键,所以共价键数目为n-1+2n+2=3n+1;(3)炔烃的通式为CnH2n-2,存在一个碳碳叁键,共价键的数目为n-1+2+2n-2=3n-1,发生某一反应后产物中含有共价键3n根,说明碳碳叁键变成碳碳双键,发生1:1的加成反应;(4)可以这样理解,如果是烷烃,则碳碳键数为n-1,现在多了4个键,增加一个环多1个共价键,一个双键多1个共价键,一个叁键多2个共价键,符合题意的是CD。
本题考查有机物的结构。(1)每个碳原子形成4个共价键,每个共价键被2个碳原子共用,所以60个碳原子形成共价键的数目为60×2=120;(2)烷烃中碳与碳之间都是单键,n个碳原子形成n-1个碳碳单键,而一个氢原子可以形成一个碳氢键,所以共价键数目为n-1+2n+2=3n+1;(3)炔烃的通式为CnH2n-2,存在一个碳碳叁键,共价键的数目为n-1+2+2n-2=3n-1,发生某一反应后产物中含有共价键3n根,说明碳碳叁键变成碳碳双键,发生1:1的加成反应;(4)可以这样理解,如果是烷烃,则碳碳键数为n-1,现在多了4个键,增加一个环多1个共价键,一个双键多1个共价键,一个叁键多2个共价键,符合题意的是CD。

练习册系列答案
相关题目
 【化学--选修3物质结构与性质】
【化学--选修3物质结构与性质】
 该配离子中含有的化学键类型有
该配离子中含有的化学键类型有