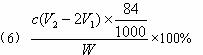题目内容
为了便于酒驾测试,生产了一种基于酸性燃料电池原理设计的酒精检测仪,
电池总反应式为:CH3CHO+O2=CH3COOH+H2O。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C.负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+
D.正极上发生的反应是:O2+4e-+2H2O=4OH-
C
【解析】
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,所以选项A不正确,氢离子向正极移动;氧气在反应中得到4个电子,所以B不正确,应该是2.24L氧气;电解质溶液显酸性,所以正极电极反应式应该是O2+4e-+4H+=2H2O,D不正确,答案选C。
考点:考查原电池的应用与判断
点评:该题是中等难度的试题,试题设计新颖,贴近高考,有利于调动学生的学习兴趣和学习积极性。该题基础性强,侧重对学生解题方法的指导与训练。该题的关键是理解并记住原电池的工作原理,然后结合题意灵活运用即可。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
四种盐在不同温度下的溶解度(g/
温度 溶解度 盐 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(说明:①>
请回答以下问题:
(1)装置的连接顺序应是__________(填字母)。
(2)A装置中盛放的试剂是__________,其作用是__________。
(3)在实验过程中,需要控制D温度在30—
(4)反应结束后,将锥形瓶浸在冷水中析出NaHCO3晶体的原因是____________________
_____________________。用蒸馏水洗涤NaHCO3晶体的目的是除去____________杂质(以化学式表示)。
(5)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色到无色(指示![]() +H+
+H+![]()
![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_______________________________。
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_______________________________。
为了便于酒驾测试,生产了一种基于酸性燃料电池原理设计的酒精检测仪,
电池总反应式为:CH3CHO+O2=CH3COOH+H2O。下列有关说法正确的是( )
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
| D.正极上发生的反应是:O2+4e-+2H2O=4OH- |