题目内容
已知2NO2(g) N2O4(g)
ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g)
ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧, 并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答下列有关问题

(1)观察到的实验现象为:_____________________________
(2)由实验现象可知,升高温度,该化学平衡向___________(填“正”或“逆”)反应方向移动,反应中NO2的转化率将_______________(填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30mL针筒中分别抽入10mLNO2气体,将针筒前端封闭。实验过程中第一支针筒不做任何操作,仅作为实验现象观察时的参照对象。
(3)某同学将第二支针筒活塞迅速推至5mL处,此时气体的颜色变深,一段时间后气体颜色又变浅了。试解释一段时间后气体颜色又变浅的原因:________________________。
(4)某同学将第三支针筒活塞迅速拉至20mL处。
①该同学观察到的现象是:__________________________
②在此过程中,该反应的化学平衡常数将______________(填“增大”、“减小”或“不变”)。
(1)A瓶中气体颜色加深,B瓶中气体颜色变浅 (2分)
(2)逆;减小
(3)增大压强,平衡向正反应方向移动,NO2浓度减小(2分)
(4)①气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅;(2分)②不变
【解析】
试题分析:A瓶,浓硫酸溶解放热,温度升高;B瓶NH4NO3固体溶解吸热,体系温度降低。(1)温度高平衡逆向进行,NO2浓度大,气体颜色加深;(2)升温平衡逆向移动,反应物转化率降低;(3)压缩体积,气体浓度增大,颜色加深;后压强增大,平衡正向移动,NO2浓度变小,颜色变浅。(4)体积增大,气体浓度降低,颜色变浅;后压强减小,平衡逆向进行,NO2浓度变大,颜色加深,但仍比第一支针筒气体的颜色浅;温度不变,平衡常数不变。
考点:考查平衡移动有关问题。

氮是地球上含量丰富的—种元素,氮及其化合物在工农业生产、生活中有着重要作用,
减少N 的氧化物在大气中的排放是环境保护的重要内容之一。

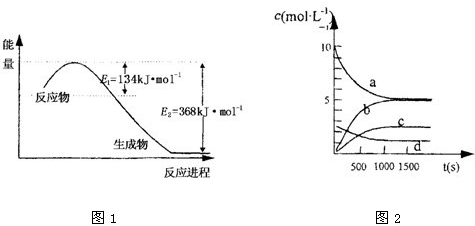
(1)上图是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________________________;
又知:N2(g)+ O2(g)=2NO(g)? △H=+180kJ/mol;2NO(g)+O2(g)=2NO2(g)? △H=-112.3kJ/mol,则反应2NO(g)+2CO(g) N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;
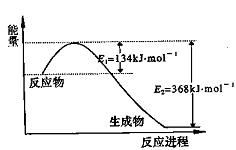
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g) + O2(g) 2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
t(s) | 0 | 500 | 1000 | 1500 |
n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K=__________,己知:K300℃>K350℃,则该反应是______热反应。
②反应达到平衡后,NO2的转化率为________________,此时若再通入一定量氮气,则NO2的转化率将___________(填“增大”、“减小”、“不变”);
③图中表示N2O5的浓度的变化曲线是____,用O2表示从0~500 s内该反应的平均速率v=________。

氮是地球上含有丰富的一种元素,氮及其化合物在公农业生产、生活中有着重
要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一。
(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出
NO2和CO反应的热化学方程式: ;
又知:N2 (g)+2NO2 (g)=4NO(g) △H=+292.3kJ?mol―1,则反应:
2NO(g)+2CO(g) ![]() N2(g)+2CO2 (g)的△H为 ;
N2(g)+2CO2 (g)的△H为 ;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2 (g)+O2 (g) ![]() 2N2O5(g);已知体系中n(NO2)随时间变化如下表:
2N2O5(g);已知体系中n(NO2)随时间变化如下表:
t(s) | 0 | 500 | 1000 | 1500 |
n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
① 写出该反应的平衡常数表达式:K= ,已知:![]() ,则该反
,则该反
应是 热反应;
② 反应达到平衡后,NO2的转化率为 ,此时若再通入一定量氮气,则NO2
的转化率将 (填“增大”、“减小”、“不变”);
③ 下图中表示N2O5的浓度的变化曲线是 ,
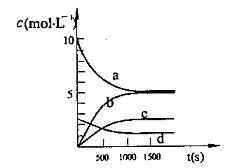
用O2表示从0~500s内该反应的平均速率v= 。

(1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图1,请写出NO2和CO反应的热化学方程式______;
又知:N2 (g)+O2 (g)=2NO(g)△H=+180kJ?mol-1;2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ?mol-1;则反应:2NO(g)+2CO2(g)?N2(g)+2CO2(g)的△H=______;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2 (g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 500 | 1000 | 1500 | |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为______,此时若再通入一定量氮气,则NO2的转化率将______(填“增大”、“减小”、“不变”);
③如图2中表示N2O5 的浓度的变化曲线是______,用O2表示从0~500s内该反应的平均速率v=______.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一。
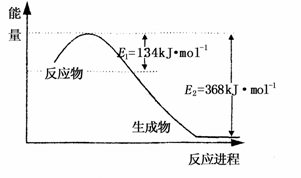
(1)上图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 ;
又知:N2 (g)+O2 (g)=2 NO(g) △H=+180kJ?mol-1;
2NO(g)+ O2(g)=2NO2(g) △H=-112.3 kJ?mol-1;
则反应:2NO(g)+2CO2(g) ![]() N2(g)+2CO2(g)的△为 ;
N2(g)+2CO2(g)的△为 ;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2(g)+O2 (g) ![]() 2 N2O5(g);已知体系中n(NO2)随时间变化如下表:
2 N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K= ,已知:K300℃>K350℃,则该反应是 热反应
②反应达到平衡后,NO2的转化率为 ,此时若再通入一定量氮气,则NO2
的转化率将 (填“增大”、“减小”、“不变”);
③右图中表示N2O5 的浓度的变化曲线是 ,
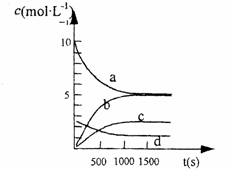
用O2表示从0~500 s内该反应的平均速率v= 。