题目内容
铜不能与稀硫酸反应,却能与浓硫酸反应,反应的方程式为:Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑
请回答:
(1)若有1mol铜反应,则参与还原反应的H2SO4物质的量为 .
(2)现用12.8g铜与足量的浓硫酸反应,可生成标准状况下SO2的体积是多少升?(写出计算过程)
(3)若用100mL 18.4mol/L的浓硫酸与足量的铜反应,却不能得到0.92mol的SO2.原因是 .
请回答:
(1)若有1mol铜反应,则参与还原反应的H2SO4物质的量为
(2)现用12.8g铜与足量的浓硫酸反应,可生成标准状况下SO2的体积是多少升?(写出计算过程)
(3)若用100mL 18.4mol/L的浓硫酸与足量的铜反应,却不能得到0.92mol的SO2.原因是
考点:化学方程式的有关计算
专题:计算题
分析:(1)参与还原反应的H2SO4生成SO2,根据方程式计算SO2的物质的量,根据S原子守恒可知n被还原(H2SO4)=n(SO2);
(2)根据n=
计算12.8g Cu的物质的量,再根据方程式生成SO2计算的物质的量,根据V=nVm计算SO2的体积;
(3)Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应.
(2)根据n=
| m |
| M |
(3)Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应.
解答:
解:(1)参与还原反应的H2SO4生成SO2,由Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑,可知1molCu反应时生成SO2的物质的量为1mol,根据S原子守恒,可知n被还原(H2SO4)=n(SO2)=1mol,
故答案为:1mol;
(2)12.8g Cu的物质的量=
=0.2mol,
Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑
1 1
0.2mol n(SO2)
n(SO2)=
=0.2mol,
故标况下,生成SO2的体积=0.2mol×22.4L/mol=4.48L,
答:生成标准状况下SO2的体积是4.48L.
(3)100mL 18.4mol/L的浓硫酸中H2SO4的物质的量=0.1L×18.4mol/L=1.84mol,若硫酸完全反应,由方程式可知生成二氧化碳的物质的量=1.84mol×
=0.92mol,由于Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应,故实际得到SO2小于0.92mol,
故答案为:由于Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应.
故答案为:1mol;
(2)12.8g Cu的物质的量=
| 12.8g |
| 64g/mol |
Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑
1 1
0.2mol n(SO2)
n(SO2)=
| 0.2mol×1 |
| 1 |
故标况下,生成SO2的体积=0.2mol×22.4L/mol=4.48L,
答:生成标准状况下SO2的体积是4.48L.
(3)100mL 18.4mol/L的浓硫酸中H2SO4的物质的量=0.1L×18.4mol/L=1.84mol,若硫酸完全反应,由方程式可知生成二氧化碳的物质的量=1.84mol×
| 1 |
| 2 |
故答案为:由于Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应.
点评:本题考查化学方程式的有关计算、氧化还原反应计算,比较基础,(3)中注意浓度为物质性质的影响.

练习册系列答案
相关题目
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱性氧化物 氧化铁 FeO |
| B、酸性氧化物 二氧化硫 SO2 |
| C、酸 硫酸 H2SO3 |
| D、碱 纯碱 Na2CO3 |
 有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH
有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH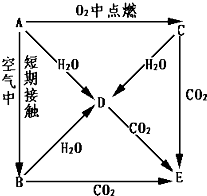 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.