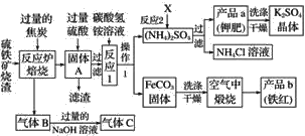
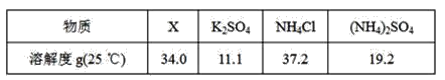
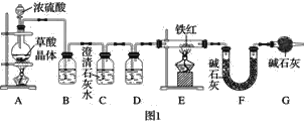
题目内容
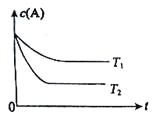
【题目】室温下,用0.1000molL-1NaOH溶液滴定20mL0.1000molL-1H3PO4溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.H3PO4的电离平衡常数Ka1约为10-2
B.当V(NaOH溶液)=40mL时,c(PO![]() )+c(OH-)=c(H+)+c(H2PO
)+c(OH-)=c(H+)+c(H2PO![]() )+2c(H3PO4)
)+2c(H3PO4)
C.当pH=7时,c(Na+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )
)
D.当V(NaOH溶液)=20mL时,c(Na+)>c(H2PO![]() )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO![]() )
)
【答案】D
【解析】
0.1000molL-1NaOH溶液滴定20mL0.1000molL-1H3PO4溶液,由图像可知,加入NaOH溶液的体积为20mL时,pH=4.7,溶液中的溶质主要为NaH2PO4,加入NaOH溶液的体积为40mL时,pH=9.7,溶液中的溶质主要为Na2HPO4,据此结合三大守恒分析解答问题。
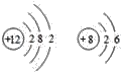
A.根据图像分析可知,未加入NaOH溶液时,H3PO4溶液的pH=1.6,则H3PO4的电离平衡常数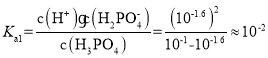 ,A选项正确;
,A选项正确;
B.当V(NaOH溶液)=40mL时,溶液中的溶质主要为Na2HPO4,则存在物料守恒c(Na+)=2c(PO![]() )+2c(HPO
)+2c(HPO![]() )+2c(H2PO
)+2c(H2PO![]() )+2c(H3PO4),电荷守恒有c(Na+)+c(H+)=3c(PO
)+2c(H3PO4),电荷守恒有c(Na+)+c(H+)=3c(PO![]() )+2c(HPO
)+2c(HPO![]() )+c(H2PO
)+c(H2PO![]() )+c(OH-),两式相减有c(PO
)+c(OH-),两式相减有c(PO![]() )+c(OH-)=c(H+)+c(H2PO
)+c(OH-)=c(H+)+c(H2PO![]() )+2c(H3PO4),B选项正确;
)+2c(H3PO4),B选项正确;
C.pH=7时,c(H+)=c(OH-),又存在电荷守恒:c(Na+)+c(H+)=3c(PO![]() )+2c(HPO
)+2c(HPO![]() )+c(H2PO
)+c(H2PO![]() )+c(OH-),所以c(Na+)=c(H2PO
)+c(OH-),所以c(Na+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() ),C选项正确;
),C选项正确;
D.当V(NaOH溶液)=20mL时,溶液中的溶质为NaH2PO4,pH=4.7,溶液显酸性,则H2PO![]() 电离大于水解,因此c(HPO
电离大于水解,因此c(HPO![]() )>c(H3PO4),D选项错误;
)>c(H3PO4),D选项错误;
答案选D。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案