题目内容
(2013?江苏三模)80℃时,将0.40mol的N2O4气体充入容积为2L的恒容密闭容器中,发生反应:N2O4(g)?2NO2(g).反应过程中测定的部分数据见下表:
|
分析:A、根据20s时二氧化氮的物质的量计算参加反应的四氧化二氮的物质的量,从而得出a值,根据v=
计算四氧化二氮的反应速率;
B、依据化学三段式列式计算80s时平衡状态的平衡常数,依据平衡常数大小比较分析;
C、加入N2O4,则平衡状态相当于增大压强,平衡左移;
D、体积缩小相当于增大压强,平衡左移.
| ||
| △t |
B、依据化学三段式列式计算80s时平衡状态的平衡常数,依据平衡常数大小比较分析;
C、加入N2O4,则平衡状态相当于增大压强,平衡左移;
D、体积缩小相当于增大压强,平衡左移.
解答:解:A、在20 s时n(N2O4)=0.28 mol,v(N2O4)=
=0.0030 mol/L?s,故A错误;
B、由表中数据可知反应在80 s时达到平衡,平衡时c(N2O4)=0.05 mol?L-1,c(NO2)=0.3 mol?L-1,平衡常数K=
=
=1.8,升高温度平衡常数增大,平衡正向移动,正反应为吸热反应,故B错误;
C、再加入N2O4后,平衡状态相当于增大压强,平衡左移,N2O4的转化率减小,故C错误;
D、当体积变为1 L时,若平衡未移动,则c(NO2)=0.6mol?L-1,实际上缩小体积相当于增大压强,平衡逆向移动,则c(NO2)<0.6 mol?L-1,故D正确;
故选D.
| ||
| 20s |
B、由表中数据可知反应在80 s时达到平衡,平衡时c(N2O4)=0.05 mol?L-1,c(NO2)=0.3 mol?L-1,平衡常数K=
| c2(NO2) |
| c(N2O4) |
| 0.32 |
| 0.05 |
C、再加入N2O4后,平衡状态相当于增大压强,平衡左移,N2O4的转化率减小,故C错误;
D、当体积变为1 L时,若平衡未移动,则c(NO2)=0.6mol?L-1,实际上缩小体积相当于增大压强,平衡逆向移动,则c(NO2)<0.6 mol?L-1,故D正确;
故选D.
点评:本题考查了化学平衡的三段式计算应用,影响因素的分析判断方法,平衡常数的计算应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
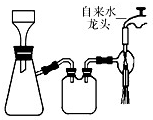 (2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:
(2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下: