题目内容
16.摩托罗拉公司研发了一种以甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:2CH3OH+3X+4NaOH═2Na2CO3+6H2O,其中X的化学式是( )| A. | O2 | B. | CO | C. | CO2 | D. | H2 |
分析 由反应的化学方程式2CH3OH+3X+4NaOH═2Na2CO3+6H2O,结合化学变化前后原子的种类、数目不变推断反应中反应物X的分子构成,根据分子的构成确定X物质的化学式.
解答 解:由反应的化学方程式2CH3OH+3X+4NaOH═2Na2CO3+6H2O,可判断反应前后C、H、O、Na四种原子的个数为:
反应前 反应后
C原子 2 2
H原子 12 12
O原子 6 12
Na原子 4 4
根据质量守恒定律的化学变化前后原子的种类、数目不变,可判断物质X的3个分子中含6个O原子,则每个X的分子由2个O原子构成,则物质X的化学式为O2;
故选A.
点评 本题考查质量守恒定律,难度不大,注意根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
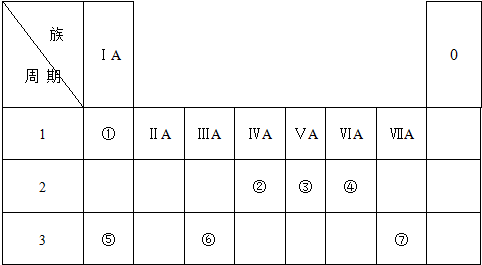
7.下表为元素周期表的一部分,请回答有关问题:
(1)⑧的元素符号是Ar;单质是原子晶体的是Si;(填写元素符号,(2)小题同)
(2)表中最活泼的金属是K,单质常温下是液体的元素是Br;
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的最高氧化物的水化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O;
(4)写出一个离子方程式,比较⑦、⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
| IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,单质常温下是液体的元素是Br;
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的最高氧化物的水化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O;
(4)写出一个离子方程式,比较⑦、⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
11.下列各种说法中,不正确的是( )
| A. | 物质的量浓度均为0.1mol•L-1的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液、水的电离程度的大小顺序是①>②>③ | |
| B. | 将100mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 | |
| C. | 向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中(NH4+)/c (NH3•H2O)先增大再减小 | |
| D. | 等物质的量的二元弱酸H2X与其钾盐K2X-的混合液中:c(K+)=c(H2X)+c(HX-)+c(X2-) |
1.电子数相同,质子数不同的两种粒子,它们可能是( )
| A. | 两种不同元素的原子 | B. | 两种不同元素的离子 | ||
| C. | 两种不同分子 | D. | 两种元素的原子和离子 |
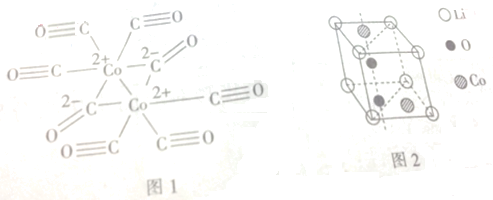
 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
. .
.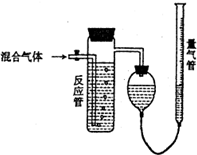 测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( ) ;②NH3的稳定性比PH3强(填写“强”或“弱”).
;②NH3的稳定性比PH3强(填写“强”或“弱”).