��Ŀ����
(12��)(1)�����Ṥҵ�����У��ҹ����û�����Ϊԭ�� ����SO2����Ӧ�Ļ�ѧ����ʽΪ�� ���÷�Ӧ�� �н��С�
(2)Ϊ��������SO2��ת��ΪSO3�����ܳ���������ܣ��� �� �˶����������Ƚ������ĽӴ���(��ͼ)�������ܱ���ϵ�������������C������������Ϊ ��A��B��C����������¶��ɸߵ��͵�˳��Ϊ ��
(3)������������ ����SO3�����������ϲ������������ٴ�ͨ�� �����еڶ����������ٽ���һ�����պ�β���к��ٵ�SO2�������գ��Է���Ⱦ������
��1��![]() �� ����¯
�� ����¯
��2��SO3��SO2��O2��C��B��A
��3��98%Ũ���ᣬ����¯
����:

(12��)��ҵ������ʱ�����ýӴ�������Ӧ��SO2ת��ΪSO3��һ���ؼ��IJ��衣
(1)�ڽӴ�����2SO2(g)+O2(g)
 2SO3(g)�ﵽƽ��״̬�ı�־��______��
2SO3(g)�ﵽƽ��״̬�ı�־��______��
A����(O2)��=2��(SO2)��
B�����������������������ʱ����仯
C���������������ɫ����ʱ����仯
D�������������ѹǿ����ʱ����仯
(2)���й��ڷ�Ӧ2SO2(g)+O2(g)
 2SO3(g)
��H<0������ͼ���в���ȷ����______ (����ĸ��ţ���
2SO3(g)
��H<0������ͼ���в���ȷ����______ (����ĸ��ţ���

(3)ij�¶���SO2(g)+ 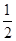 O2(g)
O2(g)
 SO3(g)
��H=-98KJ/mol
SO3(g)
��H=-98KJ/mol
�ٿ�ʼʱ������̶����ܱ������м���4mol SO2 (g)��1mol O2 (g)���ﵽƽ��ʱ ���ų�196 KJ�����������¶���SO2��ƽ��ת����Ϊ______
����֪��̬�������ȼ����Ϊ296KJ/mol������S(s)����2 molSO3(g)�Ħ�HΪ____________
(4)����SO42-����BaCl2��Һ������ʱ��BaSO4��Ksp=1.08��10-10���ֽ�������� BaCl2��Һ��2.0��10��3mol/L��H2SO4��Һ��ϡ���Ҫ����BaSO4������ԭBaCl2��Һ����СŨ��Ϊ____________
 SO2Cl2(l)
��H����97.3kJ/mol
SO2Cl2(l)
��H����97.3kJ/mol