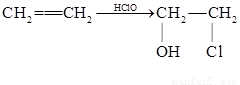题目内容
(12分)写出下列反应的热化学方程式。
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(2)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式
(3)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧热的热化学方程式
(1) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H= —319.68kJ.mol-1
(2) 4Al(s)+ 3CO2(g)=3C(s)+ 2Al2O3(s),△H= (3a-4b)kJ/mol
(3)S(s)+O2(g)=SO2(g)△H= —299.52kJ/mol (每个方程式各3分)
【解析】考查热化学方程式的书写。热化学方程式是表示化学反应与反应热关系的方程式。书写和应用热化学方程式时必须注意以下几点:
①明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数。
②各物质化学式右侧用圆括弧()表明物质的聚集状态。可以用g、l、s分别代表气态、液态、固态。固体有不同晶态时,还需将晶态注明,例如S(斜方),S(单斜),C(石墨),C(金刚石)等。溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq) 代表无限稀释水溶液。
③反应热与反应方程式相互对应。若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同。
④热化学方程式必须标明反应的浓度、温度和压力等条件,若在常温常压时可省略。
(1)根据盖斯定律可知,①+②÷2+③即得到Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l),所以该反应的反应热△H=+64.39kJ/mol-196.46kJ/mol÷2-285.84kJ/mol=-319.68kJ/mol。
(2)C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ,所以有反应①C(s)+O2(g)=CO2(g) △H=-akJ/mol和反应②Al(s)+ 3/2O2(g)=1/2Al2O3(s) △H=-bkJ/mol。根据盖斯定律可知,②×4-①×3即得到4Al(s)+ 3CO2(g)=3C(s)+ 2Al2O3(s),所以该反应的反应热△H= (3a-4b)kJ/mol。
(3)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。因此根据已知条件可知,1mol硫燃烧放出的热量是 9.36kJ×32=299.52kJ,所以硫燃烧热的热化学方程式S(s)+O2(g)=SO2(g)△H= —299.52kJ/mol。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案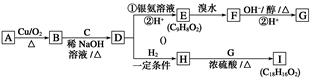

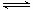 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)
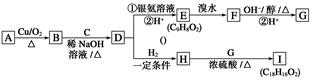

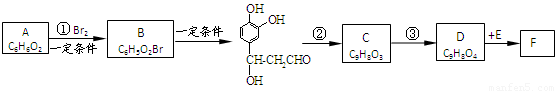
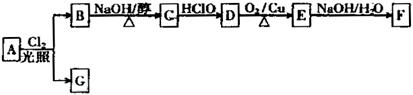
 ;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下:
;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下: