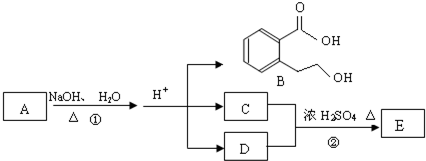
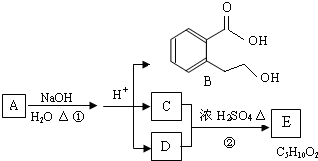
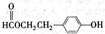题目内容
A、B、C、D、E均为可溶于水的固体,组成它们的离子可能有:Na+、Mg2+、Ba2+、ClO-、①向A的溶液中通入二氧化碳,再加入品红溶液,红色褪去。
②A、B、E的溶液的焰色反应都呈黄色
③将B和C的溶液混合,生成白色沉淀,该沉淀可溶于E溶液
④将B和D的溶液混合,生成白色沉淀,继续加入过量的E溶液,有气泡产生的同时还有白色沉淀存在。
(1)写出下列物质的化学式:A________________________,C_____________________。
(2)向B的溶液中,缓慢滴入少量的E溶液,其主要的离子方程式为__________________
________________________________________。
(1)NaClO MgCl2或Mg(ClO)2
(2)H++![]()
![]()
![]()
解析:由①知产生了HClO,故A中含有ClO-;由②知A、B、E中都含有Na+,故A为NaClO;由③④知E呈酸性应为NaHSO4,B应为Na2CO3,则D为BaCl2或Ba(ClO)2,C为MgCl2或Mg(ClO)2。而B中缓慢滴入少量的E溶液:H++![]()
![]()
![]() 。
。

练习册系列答案
相关题目