题目内容
6.CH3COOH溶于水的电离方程式为CH3COOH?CH3COO-+H+,向CH3COOH溶液中加入固体NaOH时,电离平衡向右移动(填“左”“右”或“不”),CH3COOH的电离度增大(填“增大”“减小”或“不变”,下同),电离平衡常数不变.分析 CH3COOH是弱酸部分电离,电离时电离出自由移动的氢离子和醋酸根离子;加入与弱电解质电离出相同离子的电解质抑制电离,消耗弱电解质电离出的离子,促进电离,温度不变,醋酸的电离平衡常数不变,以此来解答.
解答 解:CH3COOH是弱酸,在溶液中部分电离,其电离方程式为:CH3COOH?CH3COO-+H+,加入少量NaOH固体,电离出的氢氧根离子与CH3COOH电离生成的H+结合,使电离平衡正向移动,CH3COOH的电离度增大,弱电解质的电离为吸热过程,升高温度,电离平衡常数增大,温度不变,醋酸的电离平衡常数不变,所以该乙酸溶液电离平衡常数不变,
故答案为:CH3COOH?CH3COO-+H+;右;增大;不变.
点评 本题考查乙酸的电离,明确影响平衡移动的因素即可解答,注意加入与弱电解质电离出相同离子的电解质抑制电离,消耗弱电解质电离出的离子,电离平衡常数受温度影响,题目难度不大.

练习册系列答案
相关题目
17.某元素原子的核外有四个能层,最外能层有1个电子,该原子核内的质子数不可能为( )
| A. | 19 | B. | 24 | C. | 28 | D. | 29 |
18.下列各分散质微粒中,既能透过半透膜又能透过滤纸的是( )
| A. | 氯化铁溶液 | B. | 河水 | C. | 氢氧化铁胶体 | D. | 淀粉溶液 |
15.下列各组物质的熔点均与所含化学键的键能有关的是( )
| A. | CaO与CO2 | B. | SiC与SiO2 | C. | NaCl与HCl | D. | Cl2与I2 |
12.键线式可以简明扼要的表示碳氢化合物, 种键线式物质是( )
种键线式物质是( )
 种键线式物质是( )
种键线式物质是( )| A. | 丁烯 | B. | 丙烷 | C. | 丁烷 | D. | 丙烯 |

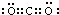 、
、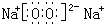 ;
;