题目内容
A、B、C、D为短周期中相邻两周期中的元素。其原子序数A>B>C>D。D和A形成简单离子后;它们电子层相差两层。已知A处于第n族,D处于第m族。且A单质中只含共价键。B的气态氢化物的分子式为H2B,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等。C和A可形成CA3型化合物,C和A、B在同一周期,B与A左右相邻。试回答:(1)若n-m=6,则A、D形成的化合物的电子式为________________。
(2)D的原子序数为(用含m的代数式表示)________________。
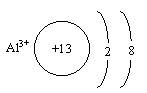
(3)C离子的结构示意图为________________。
(4)向B的氢化物的水溶液中滴入A单质的水溶液,发生反应的化学方程式为________________。
(5)向A的气态氢化物的水溶液中投入C的单质,反应的离子方程式为________________。
解析:
| 解析 本题的解题关键是B元素的确定。
确定B元素的方法有二种,分别为定性法和定量法。 定性法:根据B的气态氢化物的分子式(H2B)可得B为第ⅥA元素。由A、B、C、D为短周期元素可知B为氧元素或硫元素。因B有氧化物,故B只能为硫元素。 定量法:根据B的气态氢化物的分子式可知B显-2价,B的最高正化合价为8-2=6,则B的最高价氧化物的分子式为BO3。由B在其最高价氧化物中的质量分数为40%可求得B的相对原子质量。具体过程如下:MB/48=40/(100-40) (MB为B元素的相对原子质量) MB=32 因为B原子核内质子数和中子数相等,所以B元素的质子数=32/2=16,B为硫元素。 A元素的确定:根据A单质中只含共价键可得A为非金属元素。由原子序数A>B和A为短周期元素可知A为氯元素。 C元素的确定:根据C与A可形戍CA3型化合物,A为氯元素,在CA3中A显-1价、C显+3价,可知C为第ⅢA族元素。由于C与A、B在同一周期,故C为铝元素。离子结构示意图为 D元素的确定:根据D和A形成简单离子后,它们的电子层数相差两层,A元素的离子(Cl-)核外有三层电子,可知D的离子核外只有一层电子。由A、B、C、D为相邻两周期的元素,A、B、C为第3周期元素可知D一定为第2周期的金属元素。 (1)当n-m=6 因Cl元素位于元素周期表中第ⅦA族,n=7,故m=1,D元素位于第ⅠA族,又因D位于第2周期,故D为锂元素。 锂为活泼金属元素,氯为活泼的非金属元素,所以两者形成的化合物为离子化合物。该化合物的电子式为Li+[ (2)D元素在周期表中位于第2周期,第m族。 因周期序数=电子层数 主族序数=最外层电子数 且第一层只能容纳2个电子 故D原子核外的电子数=2+m 又因原子序数=电子数 故D的原子序数为2+m [答案](1)Li+[ (3) (4)H2S+Cl2══2HCl+S↓ (5)6H++2Al══2Al3++3H2↑ 【点评】本题为推断题。推断题常有多条解题线索,解题时一定要理清、理顺,抓住主线索。解答该类型题的步骤: (1)纵观全题,认真审题。 (2)找到解题关键。 (3)确定各元素。 (4)按题目要求解答。
|

【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
形
(2)某同学根据上述信息,所画的B电子排布图如图

违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
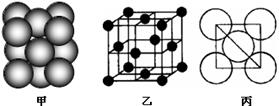
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .
【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素原子的核外p电子总数比s电子总数少1 |
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
|
C原子核外所有p轨道全满或半满 |
|
D元素的主族序数与周期数的差为4 |
|
E是前四周期中电负性最小的元素 |
|
F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形
(2)某同学根据上述信息,所画的B电子排布图如图
违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .

 。
。
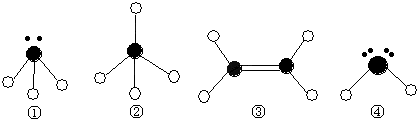

 ,违背了 原理。
,违背了 原理。