题目内容
【题目】关于下列各装置图的叙述中,错误的是

A.装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③检查乙炔的还原性
D.装置④可用于干燥、收集氨气、并吸收多余的氨气
【答案】C
【解析】
试题分析:A、电解饱和食盐水时,电流的方向是:外电路从原电池的正极流向负极,所以a是正极,b是负极,即c是在阳极,该极上是氯离子失电子产生能使湿润的淀粉KI试纸变蓝的氯气,故A正确;B、H2、NH3、Cl2、HCl、NO2可以采用排空气法来收集,收集时H2、NH3,导管是短进长出,Cl2、HCl、NO2的收集是导管长进短出,故B正确;C、乙炔中含有杂质,发生生成硫化氢,硫化氢有还原性,能使酸性高锰酸钾褪色,故C错;D、氨气的收集采用向上排空气法,导管可以短进长出,用碱石灰来。燥,用水来吸收时,要防止倒吸,故D正确。故选C。

【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
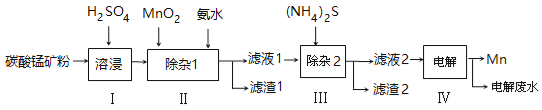
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为
。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+) :c(Ni2+)= 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)






