题目内容
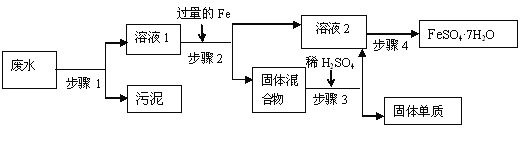
【题目】将6 g的铁粉加入200 mL Fe2(SO4)3和CuSO4的混合溶液中,充分反应可以得到200 mL 0.5mol /L FeSO4溶液和5.2 g固体沉淀物。试计算原混合溶液中Fe2(SO4)3的物质的量浓度_________________。
【答案】0.1mol/L
【解析】
溶液中含有Fe2+:0.5molL-1×0.2L=0.1mol<![]() ,则6g铁粉过量,最终溶液中只有FeSO4。
,则6g铁粉过量,最终溶液中只有FeSO4。
溶液中含有Fe2+:0.5molL-1×0.2L=0.1mol<![]() ,则6g铁粉过量,设反应消耗铁的物质的量为x,生成铜的物质的量为y;
,则6g铁粉过量,设反应消耗铁的物质的量为x,生成铜的物质的量为y;


则:3x+y=0.1mol、6g56x+64y=5.2,解得:x=0.02mol、y=0.04mol,原溶液中Fe2(SO4)3物质的量浓度为![]() =0.1mol/L。
=0.1mol/L。

练习册系列答案
相关题目