题目内容
 反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A、A、B两点的反应速率:A>B | B、B、C两点的反应平衡常数相同 | C、由状态B到状态C,可以用加热的方法 | D、A、C两点混合气体的平均相对分子质量:C>A |
分析:N2O4(g)═2NO2(g)△H=+57kJ?mol-1,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答.
解答:解:A.由图象可知,A、B两点都在等压线上,温度越高反应速率越大,A点温度高于B点,则A、B两点的反应速率:A>B,故A正确;
B.由图象可知,B、C两点所处的温度不同,C所处温度更高,升高温度平衡向正反应方向移动,平衡常数增大,故化学平衡常数KB<KC,故B错误;
C.由状态B到状态C,假设采用加热的方法,平衡向正反应方向移动,二氧化氮的含量增大,故C错误;
D.由图象可知,A、C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,则平均相对分子质量大,即平均相对分子质量为A<C,故D正确;
故选AD.
B.由图象可知,B、C两点所处的温度不同,C所处温度更高,升高温度平衡向正反应方向移动,平衡常数增大,故化学平衡常数KB<KC,故B错误;
C.由状态B到状态C,假设采用加热的方法,平衡向正反应方向移动,二氧化氮的含量增大,故C错误;
D.由图象可知,A、C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,则平均相对分子质量大,即平均相对分子质量为A<C,故D正确;
故选AD.
点评:本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”即可解答,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
 反应N2O4(g)?2NO2(g);△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g);△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )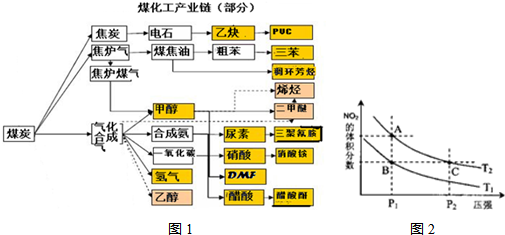
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式 对于反应N2O4(g)
对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )