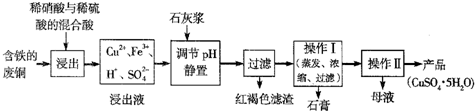
题目内容
CuSO4·5H2O晶体加热过程中依次发生如下反应:CuSO4·5H2O?CuSO4+5H2O,CuSO4?CuO+SO3
4CuO![]() 2Cu2O+O2,2SO3
2Cu2O+O2,2SO3![]() 2SO2+O2
2SO2+O2
今取25.0 g CuSO4·5H2O晶体加热,使之均匀、缓慢升温至1100℃,并恒温1 h.请回答下列问题:
(1)最终所得固体的颜色为________,质量为________g.
(2)不考虑实验带来的误差,在上述条件下,反应完毕,除去水后的气态产物的物质的量可能为________(填写下列选项).
A.0 B.0.1 mol C.大于0.1 mol D.小于0.1 mol
(3)(2)问中除上述四个选项外,你认为更准确的范围应该是________.
(4)某同学仍用25.0 g CuSO4·5H2O晶体做上述实验时,升高温度到1000℃后停止加热,得到固体的质量为7.6 g,则该固体物质的组成是________,其物质的量为___________.
解析:
| (1)红色(或砖红色),7.2
(2)C (3)大于0.125 mol,小于0.175 mol (4)CuO和Cu2O混合物,n(CuO)=0.05 mol n(Cu2O)=0.025 mol 解析:(1)按Cu原子的质量守恒n(Cu2O)= (2)假设SO3不分解,除去水后的气态产物为O2和SO3,其物质的量之和为0.125 mol,而SO3的分解反应为气体体积增大的反应,故选C. (3)SO3完全不分解,气态产物的物质的量为0.125 mol,SO3完全分解,其气态产物的物质的量为0.175 mol,而SO3的分解为可逆反应,不可能完全分解,故应在0.125 mol~0.175 mol之间. (4)采用极限法:假设固体物质只有Cu2O,其质量为7.2 g;假设固体物质只有CuO,其质量为8 g而7.2<7.6<8,故固体物质的组成为CuO和Cu2O的混合物.设CuO的物质的量为x,Cu2O的物质的量为y,按Cu原子个数守恒,
|

 名校课堂系列答案
名校课堂系列答案| A、利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | B、用品红溶液可区分二氧化碳和二氧化硫 | C、用CuSO4?5H2O检验酒精中含有的水 | D、焰色反应为黄色的某溶液中一定含有Na+ |