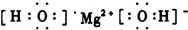题目内容
|
a、b、c、d均为短周期元素,它们在元素周期表中的位置关系如图所示.若b原子的最外层电子数是次外层电子数的3倍.下列说法中正确的是
| |
A. |
常见简单离子的半径:c>b>a |
B. |
气态氢化物的稳定性:b>d>c |
C. |
最高价氧化物对应水化物的酸性:a<d |
D. |
a的单质最稳定,不与任何物质发生化学反应 |
答案:BC
解析:
提示:
解析:
|
b原子的最外层电子数是次外层电子数的3倍,即b原子的电子层结构为
c、b、a的常见简单离子是S2-、O2-、N3+,半径大小关系是c>b、a>b.b、d、c的气态氢化物是H2O、HCl、H2S,稳定性关系是d>c、b>c、b>d,综合得b>d>c.a、d的最高价氧化物对应水化物是HNO3、HClO4,酸性关系是a<d.a的单质是N2,其化学性质是很稳定,但在一定条件下N2也能跟其他物质发生化学反应,如在电火花的条件下与O2反应生成NO;在高温、高压、催化剂的条件下与H2反应生成NH3;受豆科植物根瘤菌的作用在常温下转化为氮的化合物等等. |
提示:
|
对元素及其化合物的“位——构——性”关系进行分析及应用,就是对元素周期表的应用.它属于高考的热点,应加强练习,打好基础,提高能力. |

练习册系列答案
相关题目
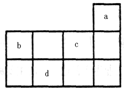 a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )
a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )| A、a原子的最外电子层上有8个电子 | B、c的最高价氧化物对应水化物为强酸 | C、d的原子半径比c的大 | D、b的非金属性比c的强 |

 .再结合图分析可知,a、b、c、d在元素周期表中的位置、元素符号如下表.
.再结合图分析可知,a、b、c、d在元素周期表中的位置、元素符号如下表.


 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
 NH3?H2O+H+
NH3?H2O+H+ 2NH3
2NH3