题目内容
【题目】25℃时,向0.1mol·L-1NaA溶液中逐滴滴加盐酸,测得混合溶液的pH与p![]() 变化关系如图所示[
变化关系如图所示[![]() =-lg
=-lg![]() ]。下列说法正确的是
]。下列说法正确的是

A. a点溶液中c(Na+)=c(A-)
B. 电离常数K(HA)的数量级为10-4
C. 滴加过程中![]() 不断减小
不断减小
D. b点溶液中c(HA)>c(Na+)>c(A-)>c(OH-)
【答案】B
【解析】
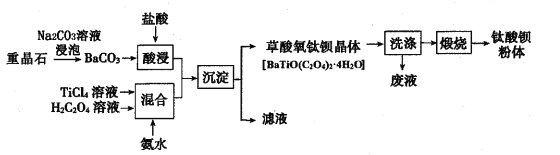
由图可知,25℃时,0.1mol·L-1NaA溶液与盐酸反应生成氯化钠和HA,a点时,溶液呈中性,溶液中c(H+)=c(OH-);b 点时,溶液呈酸性;c点时,溶液中c(A-)=c(HA),K(HA)=c(H+)。
A项、a 点pH=7,溶液呈中性,溶液中c(H+)=c(OH-),溶液中的电荷守恒关系为c(Na+)+c(H+)= c(OH-)+c(A-)+c(Cl-),则c(Na+)=c(A-)+c(Cl-),故A 错误;
B项、K(HA)= ![]() ,c点时,溶液中c(A-)=c(HA),根据 c点坐标(0,3. 45)可求知 K(HA)=c(H+)=10-3.45,数量级为10-4,故B 正确;
,c点时,溶液中c(A-)=c(HA),根据 c点坐标(0,3. 45)可求知 K(HA)=c(H+)=10-3.45,数量级为10-4,故B 正确;
C项、滴加过程中![]() =
=![]() =
=![]() ,一定温度下 K(HA)、Kw均为常数,故
,一定温度下 K(HA)、Kw均为常数,故![]() 保持不变,故C错误;
保持不变,故C错误;
D项、根据 b 点坐标(-1,5),可知 c(OH-)=1.0×10—9molL—1,![]() =10,即 c(A-)>c(HA),再根据溶液中始终存在的物料守恒c(Na+)=c(A-)+c(HA)可知,溶液中c(Na+)>c( A-),则b点溶液中c(Na+)>c(A-)>c(HA)>c(OH-),故D错误。
=10,即 c(A-)>c(HA),再根据溶液中始终存在的物料守恒c(Na+)=c(A-)+c(HA)可知,溶液中c(Na+)>c( A-),则b点溶液中c(Na+)>c(A-)>c(HA)>c(OH-),故D错误。
故选B。

【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D