题目内容
 向甲、乙两容积均为1L的恒容容器中分别充入2molPCl3、2molCl2和1molPCl3、1molCl2,T℃时,发生如下反应PCl3(g)+Cl(g)?PCl5(g)△H<0测得窗口中n(PCl3)随时间t的变化如图所示,下列叙述错误的是( )
向甲、乙两容积均为1L的恒容容器中分别充入2molPCl3、2molCl2和1molPCl3、1molCl2,T℃时,发生如下反应PCl3(g)+Cl(g)?PCl5(g)△H<0测得窗口中n(PCl3)随时间t的变化如图所示,下列叙述错误的是( )| A、在0-10min内甲容器中PCl3的反应速率为v(PCl3)=0.122mol?L-1?min-1 | B、在T℃时,该反应的平衡常数K甲=K乙 | C、若向平衡后的乙容器中充入PCl3(g),则再次达到平衡时PCl3的体积分数增大 | D、升高甲容器的温度,可以使甲容器中各物质的体积分数与乙容器的相同 |
分析:A、在0-10min内甲容器中PCl3的物质的量变化为1.22mol,根据v=
求算;
B、平衡常数只与温度有关;
C、充入PCl3(g),则PCl3的物质的量增大,故其体积分数增大;
D、升高甲容器的温度,平衡逆移,反应物转化率减小.
| △c |
| t |
B、平衡常数只与温度有关;
C、充入PCl3(g),则PCl3的物质的量增大,故其体积分数增大;
D、升高甲容器的温度,平衡逆移,反应物转化率减小.
解答:解:A、在0-10min内甲容器中PCl3的物质的量变化为1.22mol,根据v=
=
=0.122mol/(L?min),故A正确;
B、平衡常数只与温度有关,所以在T℃时,该反应的平衡常数K甲=K乙;故B正确;
C、充入PCl3(g),则PCl3的物质的量增大,平衡向正反应方向移动,PCl3转化率增大,平衡移动目的是降低浓度增大趋势,但不能消除浓度增大,达新平衡时浓度比原平衡大,故其体积分数增大,故C正确;
D、升高甲容器的温度,平衡逆移,反应物转化率减小,各物质的体积分数与乙容器的不相同,故D错误;
故选:D.
| △c |
| t |
| ||
| 10min |
B、平衡常数只与温度有关,所以在T℃时,该反应的平衡常数K甲=K乙;故B正确;
C、充入PCl3(g),则PCl3的物质的量增大,平衡向正反应方向移动,PCl3转化率增大,平衡移动目的是降低浓度增大趋势,但不能消除浓度增大,达新平衡时浓度比原平衡大,故其体积分数增大,故C正确;
D、升高甲容器的温度,平衡逆移,反应物转化率减小,各物质的体积分数与乙容器的不相同,故D错误;
故选:D.
点评:本题考查化学平衡的有关计算和影响平衡的因素,化学平衡的建立等,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
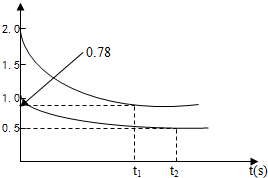 随时间变化如图所示.
随时间变化如图所示.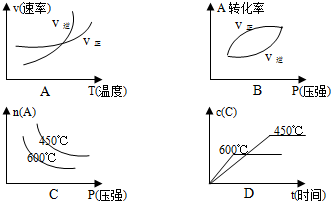 题意,下列曲线符合变化规律的是
题意,下列曲线符合变化规律的是