题目内容
如图所示(图中有部分仪器未画出),有一只为300mL的注射器,与一500mL的蒸馏烧瓶相连,烧瓶中有0.384g铜片。现向烧瓶中加入18mL 2.5mol×L-1的稀HNO3溶液,并立即用有锡箔包住的橡胶塞封住瓶口。

试回答:
(1)欲提高Cu和稀HNO3的反应速率,可采取几种不同的措施:
a.若采用加入化学试剂的方法,可加入________。
A.水 B.无水醋酸钠
C.铂丝 D.硝酸锌
b.若采用升高温度的方法,还需用的仪器有________。
(2)橡胶塞用锡箔包住的原因是________。
(3)反应开始后,烧瓶中可观察到的现象主要有:
①________________________。
②________________________。
③________________________。
(4)停止反应后,轻轻推拉注射器活塞,使气体与气体、气体与液体皆充分反应。若忽略液体体积的变化,最终溶液中NO3-的物质的量浓度与开始时相比________。
A.不变 B.变大
C.变小 D.无法确定
解析:
(1)a.C,b.酒精灯 (2)防止橡胶塞被硝酸腐蚀(氧化) (3)①铜片逐渐溶解且表面有气泡产生,②溶液颜色变蓝,③气体逐渐变成红棕色 (4)A
|
提示:
提示:第(1)问关于催化剂的选择,因为H2O本身就大量存在于稀硝酸中,显然不是本题所要找的催化剂,而NaAc中的Ac-只能降低c(H+)减缓反应速率,因此只能选择答案C;对于实验现象的描述从三方面考虑:①固体铜的变化;②溶液颜色的变化;③生成气体颜色的变化;对于第(4)问的回答记住两点:①气体与气体、气体与液体皆充分反应;②忽略液体体积的变化,因为NO与空气中O2和溶液中H2O充分反应又完全转化为NO3-:4NO+O2+2H2O═4HNO3,所以NO3-的物质的量浓度不变。
|

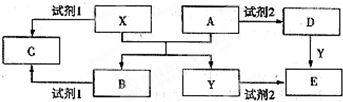

 (其中Ⅰ、Ⅱ为未知部分的结构).为推测X的分子结构,进行如图所示的转化:
(其中Ⅰ、Ⅱ为未知部分的结构).为推测X的分子结构,进行如图所示的转化:
