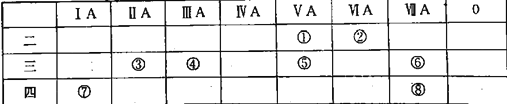
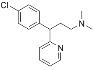
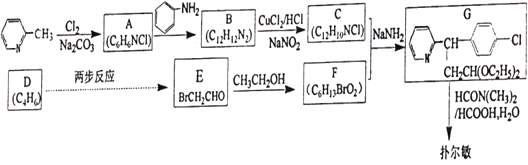
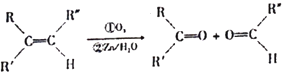
题目内容
【题目】用化学用语表示:
(1)2个铜离子__________;
(2)氧化铁中铁元素的化合价为+3价_______;
(3)溶于水温度降低的一种盐_________;
【答案】2Cu2+ ![]() NH4NO3
NH4NO3
【解析】
(1)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略;(2)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后;(3)溶于水温度降低的一种盐为硝酸铵;据此分析解答。
(1)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故:2个铜离子表示为2Cu2+,故答案为:2Cu2+;
(2)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故:氧化铁中铁元素的化合价为+3价,表示为![]() ,故答案为:
,故答案为:![]() ;
;
(3)溶于水温度降低的一种盐为硝酸铵,其化学式为NH4NO3,故答案为:NH4NO3。

 高中必刷题系列答案
高中必刷题系列答案【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
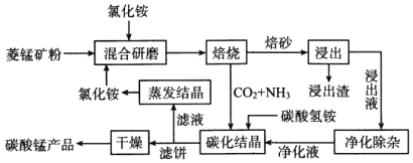
已知:①“焙烧”时发生的主要反应的化学方程式为MnCO3+2 NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O
MnCl2+2NH3↑+CO2↑+H2O
②菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
③相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
④常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。回答下列问题:
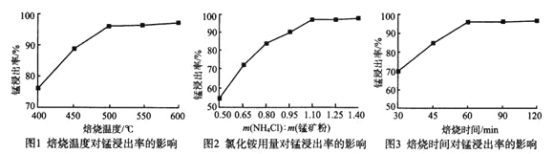
(1)分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:___________。
(2)浸出液“净化除杂”过程如下:①加入MnO2。用离子方程式表示MnO2的作用___________;
②调节溶液的pH,除去Fe3+、Al3+。溶液恰当的pH范围为___________;
③加入NH4F将Ca2+、Mg2+除去,两种沉淀共存时溶液中c(Ca2+)=1×10-5mol·L-1,则c(Mg2+)=___________。
(3)碳化结晶过程中发生反应的离子方程式为______________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,可以得到重要的无机功能材料MnO2,该电极的电极反应式为______________________。
(5)25℃时,向0 .1mol/L NH3·H2O溶液中通入HC1气体,溶液中![]() 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。

A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.NH3·H2O的Kb=1.0×10-4.7
C.pOH=3的溶液中:c(NH4+)+c(H+) +c(NH3·H2O)=0.1mol/L+c(OH-)
D.pOH=7的溶液中的溶质是NH4Cl
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量。试写出甲醇燃烧的热化学方程式:________________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2===2NH3 ΔH=a kJ·mol-1。试根据表中数据计算a的数值为________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
____________________________________________________________________________。