题目内容
|
反应 2X(g)+Y(g)
| |
| [ ] | |
A. |
T1<T2,P1<P2 |
B. |
T1<T2,P1>P2 |
C. |
T1>T2,P1>P2 |
D. |
T1>T2,P1<P2 |
答案:C
解析:
解析:
|
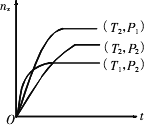
讲析:首先分析反应:这是一个气体体积减小、放热的可逆反应,由此我们可以得出这样的结论:低温、高压对反应有利,即可以促进 Z的生成,达到平衡时产物Z的物质的量nz越大,平衡点越高,即图示曲线(T2,P1).对比图示曲线(T2,P2),温度相同、压强不同,结合反应方程式,运用勒夏特列原理可知,增大压强,平衡正向移动,平衡点变高,由此分析P1>P2.再由“先拐先平”的方法验证,(T2,P1)的曲线先出现拐点,即反应时间短,进一步说明P1>P2.然后比较曲线(T2,P2)与(T1,P2),此时压强相同,温度不同,温度低的达平衡时nz大,平衡点高,由此推出温度T1>T2.再由“先拐先平”的方法可知(T1,P2)曲线先达到平衡,进一步证明T1>T2,由此得出正确结论为T1>T2,P1>P2,C选项正确.点评:本题是一道有关化学平衡的浓度-时间关系的图象题,该题基础性强,旨在引导同学们正确识别图象.这类题通常是根据图象,判断外界条件发生改变对可逆反应的影响.对此我们要把握问题的实质,正确分析图象的意义,灵活运用“先拐先平”和“定一论二”的方法进行解答. |

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
已达化学平衡的下列反应2X(g)+Y(g)  2Z(g),减小压强时,对反应产生的影响是( )
2Z(g),减小压强时,对反应产生的影响是( )
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
 2Z(g),减小压强时,对反应产生的影响是( )
2Z(g),减小压强时,对反应产生的影响是( ) 2Z(g) ΔH在不同温度(T1、T2)及压强(P1、P2)下产物Z的物质的量n(Z)与反应时间(t)的关系如下图所示,下列判断正确的是
2Z(g) ΔH在不同温度(T1、T2)及压强(P1、P2)下产物Z的物质的量n(Z)与反应时间(t)的关系如下图所示,下列判断正确的是