题目内容
常温下,向CH3COONa的水溶液中滴入一定量的CH3COOH溶液,此时溶液的pH=7,问所得溶液中c(Na+)和c(CH3COO-)的大小关系.
答案:
解析:
提示:
解析:
|
【答案】c(Na+)=c(CH3COO-) 【解析】此题考查的知识点是比较溶液中的离子浓度的大小.根据溶液是电中性的,阴、阳离子所带的正、负电荷应相等,可得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因为pH=7,即c(H+)=c(OH-),所以c(Na+)=c(CH3COO-). |
提示:
|
【方法提炼】比较溶液中的离子浓度的大小关系常运用电荷守恒原理和物料守恒原理. (1)电荷守恒:溶液中所有的阳离子所带的正电荷总数等于所有阴离子所带的负电荷总数.例如Na2CO3溶液中: c(Na+)+c(H+)=c( (2)物料守恒(原子守恒):同种元素的原子总数维持不变.例如Na2CO3溶液:c(Na+)=2[c( |

练习册系列答案
相关题目
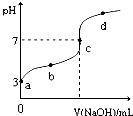 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A、a点表示的溶液中由水电离出的H+浓度为1.0×10-3mol?L-1 | ||
| B、b点表示的溶液c(CH3COO-)<c(Na+) | ||
| C、c点表示CH3COOH和NaOH恰好反应完全 | ||
D、b、d点表示的溶液中
|
常温下,向100mL0.05mol/L氢硫酸中逐渐通入氯气.下列叙述正确的是( )
| A、溶液pH先变大后变小 | B、溶液导电能力逐渐增强 | C、氢硫酸完全反应生成1.6g硫 | D、反应的离子方程式为:S2-+Cl2→2Cl-+S↓ |
 )+c(OH-)+2c(
)+c(OH-)+2c( ).
). 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl