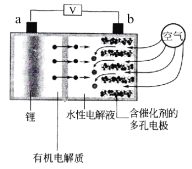
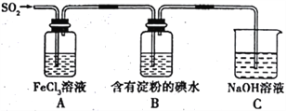
题目内容
【题目】已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:

请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2)A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G_______________________________________________________。
(4)写出反应④的化学方程式____________________________________________。
【答案】Cl2 NH3 NO NaOH H++ClO-===HClO NH3+H2O![]() NH3·H2O 2NaCl+2H2O
NH3·H2O 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
【解析】
a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,a单核带一个单位的正电荷,应为Na+;I为四核分子,则I为NH3,e为双核的阴离子,则I为OH-;物质A由a、e构成,则A为NaOH,根据④电解生成A(NaOH),可考虑到氯碱工业,再结合反应①,可知B:Cl2;C:H2;H:HCl;又因H可以与E反应,则推知E:NaClO;F:NaCl;G:H2O;M:HClO;K:O2;再结合⑤即氨的催化氧化,可知D:N2;I:NH3;J:NO。
(1)由上述分析可以知道: B为Cl2,I为NH3,J为NO;
本题答案为:Cl2 、 NH3 、 NO。
(2)因为物质A由a、e构成,a是Na+、e是OH-,则A为NaOH,故A的化学式是NaOH;
本题答案为:NaOH。
(3)①有上述分析知, H是HCl、E是NaClO、M是HClO,所以H+E(溶液)→M的离子方程式为:H++ClO-===HClO;
本题答案为:H++ClO-===HClO。
②有上述分析知,I是NH3、G是H2O,故I溶于G的离子方程式为:NH3+H2O![]() NH3·H2O;
NH3·H2O;
本题答案为:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-。
NH4++OH-。
(4)由分析知F为NaCl、G为H2O,所以反应④为电解食盐水的反应,故方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
本题答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】按要求回答下列问题:
(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为____。
(2)根据键能数据估算
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4(g)+4F2(g) =CF4(g)+4HF(g)的反应热ΔH为______kJ/mol
(3) 已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;
2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。