题目内容
过量的铝与稀盐酸反应,(不考虑酸的挥发)为了加快反应速率,同时几乎不影响生成的氢气总量,可以采取的措施是( )
| A、加入Na2SO4溶液 |
| B、再加入同浓度的盐酸 |
| C、加热,升高溶液温度 |
| D、加入适量的水 |
考点:化学反应速率的影响因素
专题:化学反应中的能量变化
分析:增大浓度、加热灯均可加快反应速率,过量的铝与稀盐酸反应,氢离子的物质的量不变,则不影响生成的氢气总量,以此来解答.
解答:
解:A.加入Na2SO4溶液,溶液总体积增大,氢离子浓度减小,反应速率减小,故A不选;
B.再加入同浓度的盐酸,反应速率不变,但生成氢气的量增大,故B不选;
C.加热,反应速率加快,生成氢气量不变,故C选;
D.加入适量的水,氢离子浓度减小,反应速率减小,故D不选;
故选C.
B.再加入同浓度的盐酸,反应速率不变,但生成氢气的量增大,故B不选;
C.加热,反应速率加快,生成氢气量不变,故C选;
D.加入适量的水,氢离子浓度减小,反应速率减小,故D不选;
故选C.
点评:本题考查化学反应速率的影响因素,为高频考点,把握习题中的信息及浓度、温度对反应速率的影响为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
检验下列有机物的方法中正确的是( )
| A、向氯仿中加入AgNO3溶液检验其含有氯元素 |
| B、用酸性KMnO4溶液鉴别乙烯和乙炔 |
| C、用FeCl3溶液鉴别苯和苯酚 |
| D、用新制Cu(OH)2悬浊液鉴别乙醇、乙醛和乙酸 |
用NA表示阿伏加德罗数的值.下列叙述正确的是( )
| A、25°C时,pH=3的1.0L NaHSO3溶液中,含Na+数目为0.001 NA |
| B、0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| C、2.3g甲苯和丙三醇的混合物中,含氢原子数目为0.2 NA |
| D、标准状况下,22.4L乙醇中含有的氧原子数为1.0NA |
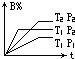 反应aA(g)+bB(g)?cC(g)△H=Q kJ/mol在不同温度(T1、T2)和不同压强(P1、P2)下,B的百分含量(B%)与时间的关系如图,则下列说法正确的是( )
反应aA(g)+bB(g)?cC(g)△H=Q kJ/mol在不同温度(T1、T2)和不同压强(P1、P2)下,B的百分含量(B%)与时间的关系如图,则下列说法正确的是( )| A、a+b<c,Q>0 |
| B、a+b>c,Q>0 |
| C、a+b<c,Q<0 |
| D、a+b>c,Q<0 |
已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0kJ?mol-1①CO(g)+
O2(g)═CO2(g)△H=-283.0kJ?mol-1②C(石墨)+O2(g)═CO2(g)△H=-393.5kJ?mol-1③则4Fe(s)+3O2(g)═2Fe2O3(s)的△H为( )
| 1 |
| 2 |
| A、+1164.1kJ?mol-1 |
| B、-1641.0kJ?mol-1 |
| C、-259.7kJ?mol-1 |
| D、-519.4kJ?mol-1 |
下列离子方程式正确的是( )
| A、碳酸钙和醋酸 CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
| B、碳酸氢钙溶液和足量氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O | ||||
| C、铜和稀硝酸反应 Cu+4H++NO3?═Cu2++NO↑+2H2O | ||||
D、硫酸铵溶液和氢氧化钠溶液共热 NH4++OH-
|
设NA为阿伏加德罗常数,下面叙述正确的是( )
| A、标准状况下,11.2L SO3所含分子数为0.5 NA |
| B、1L 1mol/L的氯化钠溶液中,所含离子数为NA |
| C、64g二氧化硫含有原子数为3NA |
| D、在反应中,1mol镁转化为Mg2+后失去的电子数为NA |
 的烃跟D2以等物质的量混合,并在一定条件下反应,所得产物的结构简式可能是(其中加重氢原子的碳原子均为*号标记)( )
的烃跟D2以等物质的量混合,并在一定条件下反应,所得产物的结构简式可能是(其中加重氢原子的碳原子均为*号标记)( )


