��Ŀ����
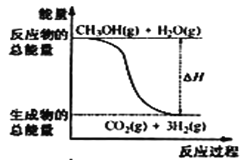
����Ŀ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���Ǣ�CH3OH(g)+H2O(g) = CO2(g)+3H2(g) ��H = + 49. 0 kJ��mol��1��CH3OH(g)+ ![]() O2(g) = CO2(g)+2H2(g) ��H =��192. 9 kJ��mol��1������˵����ȷ����
O2(g) = CO2(g)+2H2(g) ��H =��192. 9 kJ��mol��1������˵����ȷ����
A.CH3OH��ȼ����Ϊ192. 9 kJ��mol��1
B.��Ӧ���е������仯��ͼ��ʾ
C.CH3OHת���H2�Ĺ���һ��Ҫ��������
D.���ݢ���֪��Ӧ��CH3OH(l) +![]() O2(g) = CO2(g) +2H2(g) ��H >��192. 9kJ��mol��1
O2(g) = CO2(g) +2H2(g) ��H >��192. 9kJ��mol��1
���𰸡�D
��������
A�ȼ��������һ�������£�1mol��ȼ����ȫȼ�������ȶ���������ʱ���ų�����������Ӧ���������ﲻ��ˮ������������192. 9 kJ��mol��1����CH3OH��ȼ���ȣ���A����
B���Ӧ�������ȷ�Ӧ����Ӧ������������������������������B����
C�CH3OHת���H2�Ĺ��̣����շ�Ӧ�������ȷ�Ӧ�����բڷ�Ӧ�Ƿ��ȷ�Ӧ����һ��Ҫ������������C����
D�������̬�״�����������Һ̬�״�������������Һ̬�״�������Ӧ�ڷų��������٣����H��D��ȷ��
��ѡD��

��ϰ��ϵ�д�
�����Ŀ