题目内容
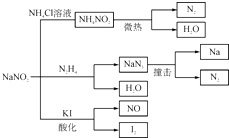
有人认为亚硝酸钠是氧化剂,有人认为它是还原剂,试用实验证明它的性质。仪器:试管、试管架、试管刷;药品:0.5mol•L-1NaNO3溶液、0.02mol•L-1KMnO4溶液、0.1mol•L-1KI溶液、2mol•L-1 H2SO4溶液、2mol•L-1NaOH溶液。
答案:
解析:
解析:
| 解题思路:依据所提供的试剂,可作如下设计:NaNO NaNO 则证明MnO4-被NO2-还原成Mn2+,NaNO2为还原剂。 (1)取适量NaNO2溶液于试管中,逐滴滴入KI(aq)和H2SO4(aq),经充分振荡,溶液呈棕黄色(生成I2的浓度大小不同,颜色也不同),则证明 NaNO2为氧化剂。2NaNO2+2KI+2H2SO4══12+2NO↑+K2SO4+Na2SO4+2H2O。 (2)取适量NaNO2溶液于试管中,逐滴滴入用硫酸酸化的KMnO4溶液,充分振荡,若溶液紫色褪去,则证明NaNO2为还原剂。 5NaNO2+2KMnO4+3H2SO4══5NaNO3+2MnSO4+K2SO4+3H2O 参考答案:见“解题思路”。
|

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目