题目内容
7.下列有关实验说法错误的是( )| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通入足量的饱和NaHCO3溶液中除去SO2 | |
| C. | 用洁净的铂丝蘸取某食盐,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐中不含KIO3 | |
| D. | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由浅红色变成红色,冷却后溶液由红色变成淡红色,说明HCO3-在水溶液中存在水解平衡 |
分析 A、二氧化硫、氯气都可以使品红溶液褪色;
B、除去混入CO2中的SO2,所选用的试剂能够将二氧化硫除去且不能够与二氧化碳反应、不能引进新的杂质;
C、钾的焰色反应能被钠的焰色反应所掩盖,观察钾的焰色反应要透过蓝色钴玻璃;
D、NaHCO3溶液和酚酞试液的试管,在室温时,溶液为无色,加热时为粉红色,因为碳酸氢根离子水解显碱性,水解过程是吸热过程,加热促进水解,碱性增强;
解答 解:A、二氧化硫能够与有机色素化合生成无色物质,具有漂白性,但是生成的无色化合物不稳定受热易恢复颜色,所以二氧化硫的漂白性具有不稳定的特点,氯气与水反应生成的次氯酸具有强的氧化性,具有漂白性,但是其漂白效果稳定,受热不恢复颜色,所以气体X可能是Cl2,故A正确;
B、饱和NaHCO3溶液既可除去SO2,碳酸氢钠与二氧化碳不反应,又可增加CO2,故B正确;
C、钾的焰色反应能被钠的焰色反应所掩盖,观察钾的焰色反应要透过蓝色钴玻璃,则该实验中不能确定是否含KIO3,故C错误;
D、碳酸氢钠水解生成氢氧化钠和碳酸,加热促进水解平衡正向进行,水解过程是吸热过程,加热促进水解,碱性增强,溶液由浅红色变成红色,冷却后平衡逆向进行,溶液由红色变成淡红色,故D正确;
故选C.
点评 本题考查了盐类水解的分析判断,物质性质的理解应用,主要是影响水解平衡的影响因素温度的改变对平衡的影响分析,题目难度中等.

练习册系列答案
相关题目
2.下列关于有机化合物的说法不正确的是( )
| A. | 用四氯化碳可以萃取乙酸水溶液中的乙酸 | |
| B. | 丁烷有两种同分异构体 | |
| C. | 乙烯可以与氢气发生加成反应,也可发生自身加聚反应生成聚乙烯 | |
| D. | 纤维素、淀粉和蛋白质都是高分子化合物 |
19.右图表示容积固定的密闭容器中进行的某一可逆反应,A(g)+2B(g)?2C(g),以B的浓度变化表示的反应速率与时间的关系,已知速率的单位为mol/(L•s)图中阴影部分的数值相当于( )
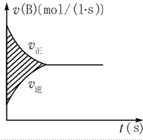

| A. | A浓度的减小量 | B. | B浓度的减小量 | ||
| C. | C物质的量的增加量 | D. | B物质的量的减少量 |
2.铝和铁是重要的金属元素,请回答下列问题:
Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为$\frac{22}{3}$,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
若在达平衡后的装置中继续加入A,B,C三种状况下的各物质,见上表:
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为$\frac{22}{3}$,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | Q |
| Fe | H2O(g) | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
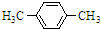 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$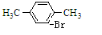 +HBr.
+HBr.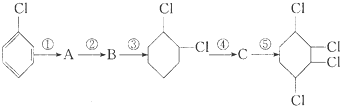
 ,B:
,B: ,C:
,C: .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ .
.