题目内容
【题目】实验室以孔雀石[主要成分是CuCO3·Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2]为原料制备CuSO4·5H2O步骤如下:
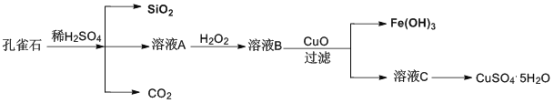
请回答下列问题:
(1)溶液A的金属离子有Fe3+和___。检验溶液A中含有Fe3的试剂是___。
(2)溶液A中加入H2O2的目的是___,发生的离子方程式为___。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、___、过滤等操作。
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为___。
【答案】Cu2+、Fe2+ KSCN 将Fe2+氧化为Fe3+ 2Fe2++2H++H2O2=2Fe3++2H2O 冷却结晶 Fe2(SO4)3+3CuO+3H2O=2Fe(OH)3+3CuSO4
【解析】
孔雀石的主要成分是CuCO3Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2,加入过量稀硫酸,生成二氧化碳气体,溶液A含有硫酸铜、硫酸亚铁和硫酸铁等,加入过氧化氢,将亚铁离子氧化生成铁离子,加入CuO调节溶液pH,使铁离子水解而生成氢氧化铁沉淀,过滤分离出溶液C,C中含有硫酸铜,经蒸发、结晶可得到硫酸铜晶体,据此分析解答。
(1)由上述分析可知,溶液A的金属离子有Fe3+和Cu2+、Fe2+;检验溶液A中含有Fe3+可以选用KSCN,如果含有铁离子,则溶液变红色,故答案为:Cu2+、Fe2+;KSCN;
(2)溶液A中加入H2O2的目的是将Fe2+氧化为Fe3+,发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:将Fe2+氧化为Fe3+;2Fe2++2H++H2O2=2Fe3++2H2O;
(3)由溶液C(主要含有CuSO4)获得CuSO45H2O晶体,需要经过加热蒸发、冷却结晶、过滤等操作,故答案为:冷却结晶;
(4)溶液B[Fe2(SO4)3]与CuO反应生成Fe(OH)3和溶液C(CuSO4)的化学方程式为Fe2(SO4)3+3CuO+3H2O=2Fe(OH)3+3CuSO4,故答案为:Fe2(SO4)3+3CuO+3H2O=2Fe(OH)3+3CuSO4。

 走进文言文系列答案
走进文言文系列答案【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化关系的是
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | S | SO3 | H2SO4 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A.AB.BC.CD.D
【题目】为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 ![]() CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验 序号 | 温度/℃ | 初始CCl4的浓度 (mol·L-1) | 初始H2的浓度 (mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | A |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为_____________。
②实验1中,CCl4的转化率A________50%(填“大于”“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值________(填序号)。
A 等于50% B 大于50% C 小于50% D 从本题资料无法判断
(2)120 ℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。

①在图中的四条线中,表示H2的起始浓度为2 mol·L-1的实验消耗CCl4的百分率变化曲线的是________(填序号)。
②根据上图曲线,氢气的起始浓度为________ mol·L