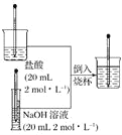
��Ŀ����
����Ŀ������������ȡ�Ļ�ѧ����ʽ�У�������������ԭ��Ӧ����(����)
A.ʵ������ȡ������Zn��H2SO4=ZnSO4��H2��
B.ʵ������ȡ������̼��CaCO3��2HCl=CaCl2��H2O��CO2��
C.ʵ������ȡ������MnO2��4HCl(Ũ)![]() MnCl2��2H2O��Cl2��
MnCl2��2H2O��Cl2��
D.��ҵ����ȡ�������ȣ�2NaClO3��4HCl(Ũ)=2NaCl��2H2O��2ClO2����Cl2��
���𰸡�B
��������
��Ԫ�ػ��ϼ۱仯�ķ�Ӧ��Ϊ������ԭ��Ӧ����֮��������Ԫ�ػ��ϼ۱仯�ķ�Ӧ��Ϊ��������ԭ��Ӧ���ݴ˷������
A��Zn��H2SO4=ZnSO4��H2����Zn��HԪ�صĻ��ϼ۱仯��Ϊ������ԭ��Ӧ����A��ѡ��
B��CaCO3��2HCl=CaCl2��H2O��CO2����û��Ԫ�صĻ��ϼ۱仯��������������ԭ��Ӧ����Bѡ��
C��MnO2+4HCl(Ũ) ![]() MnCl2+Cl2��+2H2O����Ԫ�ء���Ԫ�ػ��ϼ۶������仯����������ԭ��Ӧ����C��ѡ��
MnCl2+Cl2��+2H2O����Ԫ�ء���Ԫ�ػ��ϼ۶������仯����������ԭ��Ӧ����C��ѡ��
D��2NaClO3��4HCl(Ũ)=2NaCl��2H2O��2ClO2����Cl2����Cl�Ļ��ϼ۱仯��Ϊ������ԭ��Ӧ����D��ѡ��
��ѡB��

����Ŀ��ijС����ʵ��I��֤Fe2(SO4)3��Cu�ķ�Ӧ���۲쵽���쳣�����������������̽����
ʵ��I��
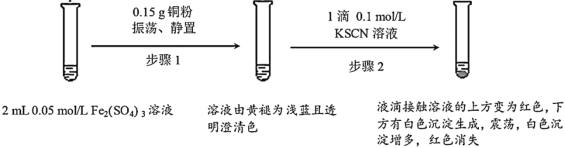
��1��Fe2(SO4)3��Һ�����³����Ե�ԭ����___��
��2��Fe2(SO4)3��KSCN��Һ��Ӧ�����ӷ���ʽΪ___��
��3��ʵ��ǰ��С��ͬѧԤ�⾭������2����Һ��Ӧ�ó��ֺ�ɫ��������__��
��4��ʵ��С���ɫ�����IJ�������������̽��
�������ϣ�i.CuSCNΪ������ˮ�İ�ɫ���塣
ii.SCN-����Ϊ��±�����ӣ�������±����������
����ʵ��ⶨ��ɫ����ΪCuSCN���������Ϻ�С��ͬѧ�²�CuSCN���������������ֿ���
�²�1��Cu2+��KSCN������������ԭ��Ӧ
�²�2���������ӽ��仹ԭCu2++Fe2+=Cu++Fe3+��Cu++SCN-=CuSCN��
Ϊ֤ʵ����С��ͬѧ����ʵ��II��III����FeSO4��CuSO4��ҺŨ��Ϊ0.1mol/L��KSCN��ҺŨ��Ϊ0.4mol/L��
ʵ����� | �Ա�ʵ�鼰�Լ� | ʵ�鲽�� | ʵ������ |
II |
| ����1mLKSCN��Һ | ��ʼʱ��Һ���Ϸ���Ϊ��ɫ��һ��ʱ����ɫ�������ӣ���������֧�Թ� |
| ����1mLKSCN��Һ | ��Һ�����ɫ |
�ٲ²�1�����ӷ���ʽ____��
��ʵ��II���Թ�__������ĸ���е��������֤ʵ�²�1��������
ʵ����� | �Ա�ʵ�鼰�Լ� | ʵ�鲽�� | ʵ������ |
| ����2mLCuSO4��Һ | ��Һ��Ϊ����ɫ | |
�ټ���1mLKSCN��Һ | ��Һ���ϲ��Ϊ��ɫ���а�ɫ����������һ��ʱ�����֧�Թ���Һ�ʺ�ɫ | ||
| ����4mLCuSO4��Һ | ��Һ��Ϊ����ɫ | |
�ټ���1mLKSCN��Һ | ��Һ���ϲ��Ϊ��ɫ���а�ɫ����������һ��ʱ�����֧�Թ���Һ��dz��ɫ | ||
| ����2mLCuSO4��Һ | ��Һ��Ϊ����ɫ | |
�ټ���1mLKSCN��Һ | ��Һ���ϲ��Ϊ��ɫ���а�ɫ����������һ��ʱ�����֧�Թ���Һ�����ɫ |
��5��Fe3+�������Ա�Ӧǿ��Cu2+�����ʵ��III�е��������Cu2++Fe2+=Cu++Fe3+����������ԭ����___��
��6��ʵ��С��������ϲ����ۺ�ó�����Һ�������ڷ�Ӧʱ�����ֵ�������ǿ������Ӧ��ԭ����ļ�̬��״̬�йء��ɴ˷�������CuSCN����ʹCu2+����������ǿ��������ʵ���һ��֤���������ʵ����___��
����Ŀ����������1mol��ѧ�������γ���̬ԭ������Ҫ��������![]() ��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����( )
��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����( )
���ۼ� | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. �������ȶ��Ĺ��ۼ���H-F��
C. H2(g)��2H(g) ��H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) ��H=-25kJ/mol