题目内容
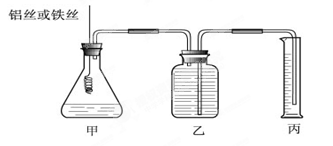
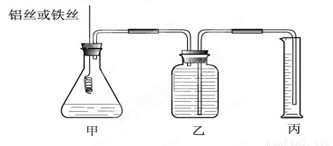
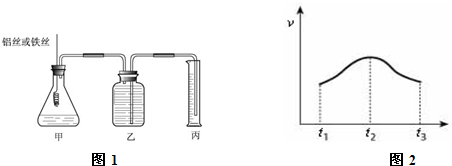
某研究小组为比较Al和Fe的金属性强弱,设计了图1所示的装置,甲中锥形瓶内盛放的是100ml稀盐酸(反应前后溶液体积变化可以忽略不计).
(1)若要比较产生气体的快慢有两种方法,一种是比较产生相同体积气体所需的时间,另一种是比较
(2)为了确保“Al和Fe的金属活动性不同是导致产生气体速率不同的唯一原因”,实验时需要控制好反应条件.实验时除需保证甲中液体的体积、物质的量浓度和温度相同外,还需保证
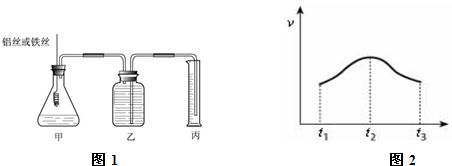
(3)实验测得产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间内速率逐渐加快说明该反应是
(4)能使甲中的反应停止的操作是
(1)若要比较产生气体的快慢有两种方法,一种是比较产生相同体积气体所需的时间,另一种是比较
相同时间内产生气体体积大小
相同时间内产生气体体积大小
.(2)为了确保“Al和Fe的金属活动性不同是导致产生气体速率不同的唯一原因”,实验时需要控制好反应条件.实验时除需保证甲中液体的体积、物质的量浓度和温度相同外,还需保证
Al和Fe表面积相同
Al和Fe表面积相同
.(3)实验测得产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间内速率逐渐加快说明该反应是
放热
放热
(填放热或吸热)反应,t2~t3时间内速率逐渐减慢的主要原因是盐酸浓度不断减小
盐酸浓度不断减小
.(4)能使甲中的反应停止的操作是
铁丝或铝丝从溶液中拔出
铁丝或铝丝从溶液中拔出
.
分析:(1)根据v=
分析;
(2)由外界条件对化学反应速率的影响分析;
(3)由外界条件对化学反应速率的影响分析;
(4)由反应物分析.
| △V |
| △t |
(2)由外界条件对化学反应速率的影响分析;
(3)由外界条件对化学反应速率的影响分析;
(4)由反应物分析.
解答:解:(1)由v=
知,反应速率与气体的体积和时间有关,所以一种是固定体积比较时间,另一种是固定时间比较体积.
故答案为:相同时间内产生气体体积大小;
(2)影响化学反应速率的因素有反应物的浓度、溶液的温度、固体的表面积等,所以还需保证Al和Fe表面积相同.
故答案为:Al和Fe表面积相同;
(3)该反应是一个放热的反应,随着反应的进行,放出的热量越多,溶液的温度越高,温度越高反应速率越大;随着反应的进行,溶液中盐酸的浓度不断减小,浓度越小反应速率越小.
故答案为:放热;盐酸浓度不断减小;
(4)要想使反应停止,没有反应物即可,所以将铁丝或铝丝从溶液中拔出即可停止反应.
故答案为:铁丝或铝丝从溶液中拔出.
| △V |
| △t |
故答案为:相同时间内产生气体体积大小;
(2)影响化学反应速率的因素有反应物的浓度、溶液的温度、固体的表面积等,所以还需保证Al和Fe表面积相同.
故答案为:Al和Fe表面积相同;
(3)该反应是一个放热的反应,随着反应的进行,放出的热量越多,溶液的温度越高,温度越高反应速率越大;随着反应的进行,溶液中盐酸的浓度不断减小,浓度越小反应速率越小.
故答案为:放热;盐酸浓度不断减小;
(4)要想使反应停止,没有反应物即可,所以将铁丝或铝丝从溶液中拔出即可停止反应.
故答案为:铁丝或铝丝从溶液中拔出.
点评:本题考查了化学反应速率的影响因素,外界条件影响化学反应速率,但决定化学反应速率的是物质本身的性质.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目