题目内容
13.①标准状况下5.6L氢气、②33g二氧化碳、③0.5mol氯气、④2.408×1023氦气(He)四种物质,下列排序错误的是( )| A. | 四种物质所含分子数目从大到小的顺序是:②>③>④>① | |
| B. | 四种物质质量从大到小的顺序是:③>②>④>① | |
| C. | 四种气体在标准状况下的体积从大到小的顺序是:②>③>④>① | |
| D. | 四种物质所含原子数目从大到小的顺序是:②>③>④>① |
分析 根据n=$\frac{V}{{V}_{m}}$计算氢气物质的量,根据n=$\frac{m}{M}$计算二氧化碳物质的量,根据n=$\frac{N}{{N}_{A}}$计算氦气物质的量.
A.分子数目之比等于其物质的量之比;
B.根据m=nM计算氢气、氯气、氦气的质量,再进行比较;
C.相同条件下,体积之比等于物质的量之比;
D.结合分子式计算各物质中原子的物质的量,注意氦气为单原子分子.
解答 解:①标准状况下5.6L氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,②33g二氧化碳物质的量为$\frac{33g}{44g/mol}$=0.75mol,③0.5mol氯气,④2.408×1023氦气(He)的物质的量为$\frac{2.408×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.4mol.
A.分子数目之比等于其物质的量之比,故分子数目从大到小的顺序是:②>③>④>①,故A正确;
B.氢气质量为0.25mol×2g/mol=0.5g,氯气为0.5mol×71g/mol=35.5g,氦气的质量为0.4mol×4g/mol=1.6g,四种物质质量从大到小的顺序是:③>②>④>①,故B正确;
C.相同条件下,体积之比等于物质的量之比,故标准状况下的体积从大到小的顺序是:②>③>④>①,故C正确;
D.氢气含有原子为0.25mol×2=0.5mol,二氧化碳含有为0.75mol×3=2.25mol,氯气含有原子为0.5mol×2=1mol,氦气是单原子分子,含有原子为0.4mol,故所含原子数目从大到小的顺序是:②>③>①>④,故D错误,
故选:D.
点评 本题考查物质的量的有关计算,难度不大,注意掌握以物质的量为中心的计算,注意稀有气体是单原子分子.

| A. | 钢铁发生电化学腐蚀时,负极发生的反应是:Fe-3e-═Fe3+ | |
| B. | 将钢铁与电源的正极相连,可防止钢铁被腐蚀 | |
| C. | 在镀件上镀铜时纯铜作阴极 | |
| D. | 钢铁腐蚀中,吸氧腐蚀比析氢腐蚀更普遍 |
| A. | 江河入海口三角洲的形成 | B. | 向豆浆中加入石膏可制得豆腐 | ||
| C. | FeCl3溶液呈现黄色 | D. | 不同品牌的墨水不能混用 |
| A. | Na 着火可以使用泡沫灭火器 | |
| B. | 绿色化学是指有毒气体尾气要经过无毒处理后在排放 | |
| C. | 实验室用浓硫酸溶解铜制备硫酸铜 | |
| D. | 实验室可以适当温度下,使铜片在持续通入空气的稀硫酸中溶解的方法制备硫酸铜 |
| A. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| B. | SO2+2H2S═3S+2H2O | |
| C. | 3NO2+H2O═2HNO3+NO | |
| D. | 3S+6KOH═2K2S+K2SO3+3H2O |

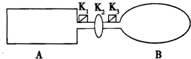 如图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量的1molNO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L.已知:2NO2(g)?N2O4(g)△H<0
如图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量的1molNO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L.已知:2NO2(g)?N2O4(g)△H<0