题目内容
元素周期表中部分短周期元素的位置如图所示,其中A元素最外层电子数是其电子层数的2倍.下列有关A、B、C、D、E五种元素的叙述不正确的是( )

| A.A与B形成的阴离子可能有AB32-、A2B42- |
| B.E的氢化物的沸点比C的氢化物的沸点高 |
| C.A在过量的B2中燃烧的主要产物为AB2 |
| D.A与E形成的化合物是非极性分子 |

A元素最外层电子数是其电子层数的2倍,则A元素原子有2个电子层,最外层电子数为4,故A为碳元素,由A、B、C、D、E五种元素在短周期中的相对位置可知,B为氧元素,C为氟元素,D为硫元素,E为氯元素,
A、A为碳元素,B为氧元素,碳元素与氧元素可以形成碳酸根离子(CO32-)、草酸根离子C2O42-,故A正确;
B、氟化氢分子中存在氢键,氢键比分子间作用力强,氟化氢的沸点高于氯化氢,故B错误;
C、碳在足量的氧气中燃烧生成二氧化碳,故C正确;
D.A与E形成的化合物是四氯化碳,为正四面体结构,是对称结构,正电荷重心与负电荷重心重合,为非极性分子,故D正确;
故选B.
A、A为碳元素,B为氧元素,碳元素与氧元素可以形成碳酸根离子(CO32-)、草酸根离子C2O42-,故A正确;
B、氟化氢分子中存在氢键,氢键比分子间作用力强,氟化氢的沸点高于氯化氢,故B错误;
C、碳在足量的氧气中燃烧生成二氧化碳,故C正确;
D.A与E形成的化合物是四氯化碳,为正四面体结构,是对称结构,正电荷重心与负电荷重心重合,为非极性分子,故D正确;
故选B.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
现有四种短周期元素的有关信息如下表所示:
| 元素 | 结构特点及在周期表中的位置 | 单质及化合物的部分性质与用途 |
| 甲 | 在元素周期表中,主族序数等于周期数 | 工业上用电解法冶炼该金属 |
| 乙 | 单质的晶体类型为原子晶体 | 氧化物是工业制普通玻璃的主要原料 |
| 丙 | 原子最外层电子数是最内层电子数的2倍 | 单质存在多种同素异形体 |
| 丁 | 元素能形成两种不同的阴离子 | 丁的一种单质与KI溶液反应生成另一种丁的单质 |
则甲、乙、丙、丁四种元素的原子序数从大到小排列的是 ( )
A.甲、乙、丙、丁 B.丁、甲、乙、丙
C.丙、丁、甲、乙 D.乙、甲、丁、丙



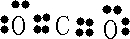
 H++Cl-+HClO
H++Cl-+HClO

