题目内容
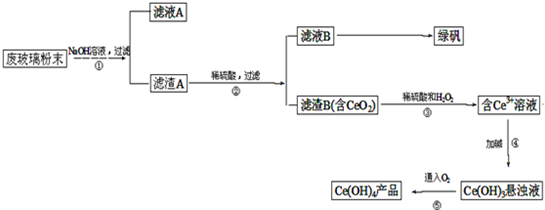
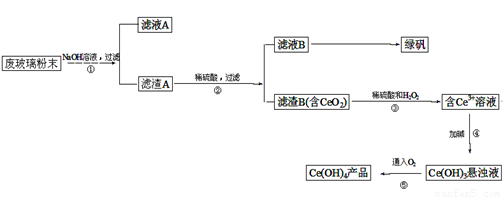
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:

(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗涤的方法是
。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536g,加硫酸溶解后,用0.1000mol?L-1FeSO4标准溶液滴定终点是(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为 。
(1)滤渣上附着的Fe3+、Cl-等, 取最后洗涤液少量于试管中,滴加几滴AgNO3溶液,如无白色沉淀,则洗干净。
(2)2CeO2+H2O2+6H+ =2Ce3++O2↑+4H2O SiO2
(3)不能 分液漏斗
(4)97.01%
【解析】该反应过程为:①CeO2、SiO2、Fe2O3等中加入稀盐酸,Fe2O3转化为FeCl3存在于滤液中,滤渣为CeO2和SiO2,②加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2,③加入碱后Ce3+转化为沉淀,④通入氧气讲Ce从+3氧化为+4,得到产品。
Ce(OH)4 ——— FeSO4
n(Ce(OH)4) = n(FeSO4) = 0.1000mol/L×0.025L = 0.0025mol, m = 0.0025mol×208g/mol = 0.52g
0.52÷0.536×100%=97.01%
【考点定位】以工艺流程为基础,考查化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案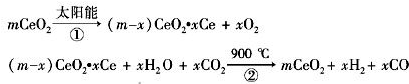
下列说法不正确的是( )
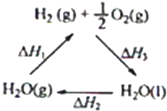
| A、该过程中CeO2没有消耗 | B、该过程实现了太阳能向化学能的转化 | C、右图中△H1=△H2+△H3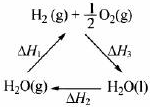 | D、以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-═CO32-+2H2O |
 某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?xCe+xH2O+xCO2
| 900℃ |
| ① |
下列说法不正确的是( )
| A、该过程中CeO2没有消耗 |
| B、该过程实现了太阳能向化学能的转化 |
| C、图中△H1=△H2+△H3 |
| D、以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O |