题目内容
15.根据下图所示装置回答下列问题.
(1)甲池是原电池装置,其中OH-移向CH3OH极(填“CH3OH”或“O2”)
(2)写出通入CH3OH的电极的电极反应式是CH3OH-6e-+8OH-═6H2O+CO32-.
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为A极(填“A”或“B”),并写出此电极的电极反应式4OH--4e-=O2↑+2H2O.
(4)乙池中总反应的离子方程式为4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+.
(5)当乙池中B(Ag)极的质量增加4.32g时,乙池的pH是1(忽略AgNO3溶液的水解,若此时乙池中溶液的体积为400mL);此时丙池某电极析出1.28g某金属,则丙中的某盐溶液可能是(填序号)B.
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3.
分析 (1)图中甲池能自发进行氧化还原反应,属于原电池,原电池中的阴离子移向负极;
(2)通入甲醇的电极为负极、通入氧气的电极为正极,负极上发生失电子的氧化反应;
(3)电解池中连接原电池负极的电极为阴极、连接原电池正极的电极为阳极,根据电极反应式确定现象;
(4)电解硝酸银生成硝酸、氧气和水;
(5)根据银和氢离子关系式计算氢离子浓度,从而确定溶液的pH,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素.
解答 解:(1)图中甲池是燃料电池,通入甲醇的电极为负极、通入氧气的电极为正极将化学能转化为电能,所以属于原电池,原电池中,阴离子移向负极CH3OH极,
故答案为:原电池;CH3OH;
(2)通入甲醇的电极为负极,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-═6H2O+CO32-,故答案为:CH3OH-6e-+8OH-═6H2O+CO32-;
通入氧气的电极为正极,A连接原电池正极,为电解池阳极,故答案为:阳极;
(3)A是阳极,氢氧根离子失电子发生氧化反应4OH--4e-=O2↑+2H2O,该电极负极氢离子浓度增加,显示酸性,遇到石蕊显示红色,
故答案为:A;4OH--4e-=O2↑+2H2O;
(4)乙池中A电极上氢氧根离子放电、阴极上银离子放电,所以乙池电池反应式为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
(5)当乙池中B(Ag)极的质量增加4.32g即0.04mol时,设氢离子浓度为xmol/L,
4Ag++2H2O=4Ag+O2↑+4H+ 反应转移电子
4 4 4
0.04mol 0.4xmol 0.04mol
x=0.1,则溶液的pH=1,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出1.28g金属时转移电子是0.04mol,
A、硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故错误;
B、电解硫酸铜溶液时,阴极上析出1.28g即0.02mol铜需要转移电子0.04mol,故正确;
C、氯化钠中钠元素处于氢元素前,所以阴极上不析出金属单质,故错误;
D、电解硝酸银溶液时,阴极上析出1.28g银需要转移电子0.011mol<0.05mol,故错误;
故选B.
点评 本题考查了原电池和电解池原理,涉及电极反应式的书写及物质的量的金属,会结合电解质溶液酸碱性书写电极反应式,再结合转移电子相等进行计算,题目难度不大.

| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,将相同的铝片分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加Na2S溶液可以得到Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氢硫酸是一种二元弱酸:H2S?S2-+2H+ | |
| B. | 在银氨溶液中滴加过量稀硝酸:[Ag(NH3)2]++2H+═Ag++2NH4+ | |
| C. | 硝酸铁溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | 铅蓄电池充电时的阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
| A. | 乙酸+Na2CO3 | B. | 乙酸+NaOH | C. | 乙酸+乙醇 | D. | 乙酸+Fe |
| A. | 2.4 g金属镁在反应中全部变成镁离子时,失去的电子数目为0.1NA | |
| B. | 2 g氢气所含氢原子数目为NA | |
| C. | 17 g OH- 所含的质子数目为10NA | |
| D. | 58.5 g NaCl中所含有的Na+离子数目为NA |
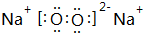 ,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
 为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;若生成4.29g Cu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).
为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;若生成4.29g Cu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).