题目内容
【题目】已知反应 CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH<0。在恒温恒压密闭容器中,反应达到平衡。下列叙述正确的是( )。
CO2(g) + H2(g) ΔH<0。在恒温恒压密闭容器中,反应达到平衡。下列叙述正确的是( )。
A.充入一定量的氙气,n(H2)不变B.增大压强,n(CO2)减小
C.更换高效催化剂,CO 转化率增大D.降低温度,平衡常数 K 减小
【答案】A
【解析】
A. 恒温恒压密闭容器中,充入氙气,反应前后气体体积不变,对参加反应的气体没有影响,平衡不移动,n(H2)不变,故A正确;
B. 反应前后体积不变,改变压强,平衡不移动,故B错误;
C. 更换高效催化剂,平衡不移动,CO的转化率不变,故C错误;
D. 正反应放热,升高温度平衡向逆反应方向移动,平衡常数减小,降低温度,平衡常数 K增大,故D错误;
答案选A。

【题目】研究与深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁。高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/°C | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
则该反应的平街常数表达式K=_________,H_________0(填“>”、“<”或“=”)。
(2)CO2可用于生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
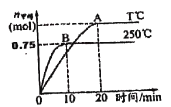
请分析并回答下列问题:
250°C时,反应在前10min的平均速率v(H2)_________molL-1min-1,从反应开始到平衡,CO2转化率为_________%。相同温度下,若某时刻该容器中含有1 mol H2、1.2mol CO2、0.8mol CH3OH、1.5 mol H2O,则此时反应所处的状态为____________________________________(填“向正反应方向进行中”、“向逆反应方向进行中心”或“平衡状态”)。