��Ŀ����
��������������������Һ��Ӧ�������õ�����Ϊ4.48L ����״������
��1���÷�Ӧ�����ӷ���ʽΪ
��2����ѡ��������ǩΪ2.0mol?L-1���������ƣ������������������Һ
��3����ѡ��������ǩΪ10%���ܶ�Ϊ1.043g?mL-1���������к�������Ӧ�������ĵ��������ƣ������������
��1���÷�Ӧ�����ӷ���ʽΪ
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
����2����ѡ��������ǩΪ2.0mol?L-1���������ƣ������������������Һ
200
200
��������3����ѡ��������ǩΪ10%���ܶ�Ϊ1.043g?mL-1���������к�������Ӧ�������ĵ��������ƣ������������
140.0
140.0
����������С�����һλ������������1���������������Ʒ�Ӧ�����Ȼ��ơ��������ơ���ˮ���ݴ���д��
��2������n=
�������������ʵ��������ݷ���ʽ����μӷ�Ӧ��NaOH�����ʵ���������V=
������Ҫ����������Һ�������
��3���к��������ƣ�ǡ�÷�Ӧ��Ҫ�����������٣���ʱn��HCl��=n��NaCl��������c=
������������ʵ���Ũ�ȣ����ݸ���V=
������Ҫ����������
��2������n=
| V |
| Vm |
| n |
| c |
��3���к��������ƣ�ǡ�÷�Ӧ��Ҫ�����������٣���ʱn��HCl��=n��NaCl��������c=
| 1000�Ѧ� |
| M |
| n |
| c |
����⣺��1���������������Ʒ�Ӧ�����Ȼ��ơ��������ơ���ˮ����Ӧ���ӷ���ʽΪ��Cl2+2OH-=Cl-+ClO-+H2O��
�ʴ�Ϊ��Cl2+2OH-=Cl-+ClO-+H2O��
��2�������4.48L���������ʵ���Ϊ
=0.2mol�����ݷ���ʽCl2+2OH-=Cl-+ClO-+H2O��֪���μӷ�Ӧ��NaOH�����ʵ���Ϊ0.2mol��2=0.4mol������Ҫ����������Һ�����Ϊ
=0.2L=200mL��
�ʴ�Ϊ��200��
��3���к��������ƣ�ǡ�÷�Ӧ��Ҫ�����������٣���ʱn��HCl��=n��NaOH��=0.4mol��
����������ʵ���Ũ��Ϊ
mol/L=2.858mol/L��
����Ҫ��������Ϊ
=0.14L=140.0mL��
�ʴ�Ϊ��140.0��
�ʴ�Ϊ��Cl2+2OH-=Cl-+ClO-+H2O��
��2�������4.48L���������ʵ���Ϊ
| 4.48L |
| 22.4L/mol |
| 0.4mol |
| 2mol/L |
�ʴ�Ϊ��200��
��3���к��������ƣ�ǡ�÷�Ӧ��Ҫ�����������٣���ʱn��HCl��=n��NaOH��=0.4mol��
����������ʵ���Ũ��Ϊ
| 1000��1.043��10% |
| 36.5 |
����Ҫ��������Ϊ
| 0.4mol |
| 2.858mol/L |
�ʴ�Ϊ��140.0��
���������⿼�����ʵ���Ũ�ȵ��йؼ��㡢���ݷ���ʽ���еļ��㣬�Ѷ��еȣ�ע�⣨3�������ʵ���Ũ�������������Ĺ�ϵ��

��ϰ��ϵ�д�
�����Ŀ
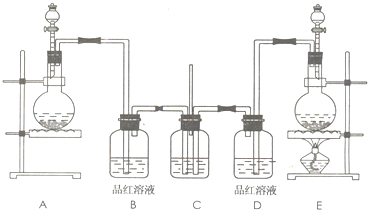
 ijͬѧ�����ͼװ�ã��о��ǽ���Ԫ�����ʱ仯���ɣ�
ijͬѧ�����ͼװ�ã��о��ǽ���Ԫ�����ʱ仯���ɣ� I���±���ʵ�����Ʊ�������й����ݣ�
I���±���ʵ�����Ʊ�������й����ݣ�