题目内容
8.铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸.工作时该电池总反应式为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.根据上述情况判断:(1)蓄电池的负极材料是Pb;工作时,正极反应为PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(2)工作时,电解质溶液的pH增大(填“增大”、“减小”或“不变”);
(3)工作时,电解质溶液中的阴离子移向负极;电流方向从正极流向负极;
(4)充电时,铅蓄电池的负极与电源的负极相连.
分析 (1)铅蓄电池中,负极上金属失电子化合价升高;正极得电子发生还原反应;
(2)铅蓄电池工作时,硫酸参加反应生成硫酸铅,溶液中氢离子浓度降低;
(3)工作时,阴离子向负极移动,电流从正极流向负极;
(4)充电时,铅蓄电池的负极与电源的负极相连.
解答 解:(1)铅蓄电池中,根据原电池反应式中元素化合价变化知,Pb中Pb元素化合价由0价变为+2价,被氧化发生氧化反应,所以Pb作负极,正极PbO2得电子发生还原反应,反应为PbO2+2e-+4H++SO42-=PbSO4+2H2O,故答案为:Pb;PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(2)铅蓄电池工作时,硫酸参加反应生成硫酸铅同时生成水,导致硫酸浓度降低、酸性减小,则pH增大,故答案为:增大;
(3)工作时,电解质溶液中的阴离子移向负极;电流方向从正极流向负极;
答案为:负;正;负;
(4)充电时,铅蓄电池的负极与电源的负极相连,故答案为:负.
点评 本题考查原电池工作原理的应用,题目难度中等,注意把握电极方程式的书写方法,首先考虑原电池反应所依据的氧化还原反应,再考虑产物与电解质溶液的反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列过程与配合物的形成无关的是( )
| A. | 向一定量的AgNO3溶液中加入氨水至沉淀消失 | |
| B. | 向一定量的AlCl3中滴加NaOH直到沉淀消失 | |
| C. | 向一定量的CuSO4溶液中加入氨水至沉淀消失 | |
| D. | 向FeCl3溶液中加入KSCN溶液 |
3.甲醇是重要的化学工业基础原料和液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
(3)判断反应③△H<0;△S<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,
若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
(3)判断反应③△H<0;△S<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,

若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
13.氮的化合物既是一种资源,也会给环境造成危害.
I.氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?(NH2)2CO(s)+H2O(g),△H=-x KJ/mol (x>0),其他相关数据如表:
则表中z(用x a b d表示)的大小为x-d+b+2a.
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图2所示,该反应到达平衡时CO2的平均反应速率为0.00417mol/(L•s),此温度时的平衡常数为8.

下列能使正反应的化学反应速率加快的措施有②③.
①及时分离出尿素 ②升高温度 ③向密闭定容容器中再充入CO2 ④降低温度
Ⅱ.氮的氧化物会污染环境.目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质.某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体).
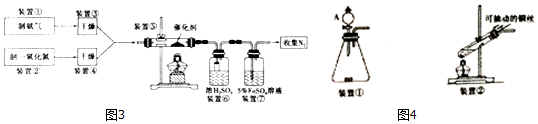
(l)写出装置⑤中反应的化学方程式4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O.
(2)装置①和装置②如图4,仪器A的名称为分液漏斗,其中盛放的药品名称为浓氨水.
装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是产生CO2,排出装置中的空气,防止NO被氧化.
(3)装置⑥中,小段玻璃管的作用是防倒吸;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是溶液变浑浊.
I.氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?(NH2)2CO(s)+H2O(g),△H=-x KJ/mol (x>0),其他相关数据如表:
| 物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图2所示,该反应到达平衡时CO2的平均反应速率为0.00417mol/(L•s),此温度时的平衡常数为8.

下列能使正反应的化学反应速率加快的措施有②③.
①及时分离出尿素 ②升高温度 ③向密闭定容容器中再充入CO2 ④降低温度
Ⅱ.氮的氧化物会污染环境.目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质.某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体).

(l)写出装置⑤中反应的化学方程式4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O.
(2)装置①和装置②如图4,仪器A的名称为分液漏斗,其中盛放的药品名称为浓氨水.
装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是产生CO2,排出装置中的空气,防止NO被氧化.
(3)装置⑥中,小段玻璃管的作用是防倒吸;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是溶液变浑浊.
20.下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 向某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水后变浑浊 | 该溶液中一定有CO32- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 氯水可以使有色布条褪色 | 氯气具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
17.a、b、c、d、e是原子序数依次增大的短周期元素,a是周期表中原子半径最小的元素,b2-和c2+的电子层结构相同,e的核电荷数是b的2倍,元素d的合金是日常生活中使用最广泛的金属材料之一.下列说法正确的是( )
| A. | 元素b的简单气态氢化物的热稳定性比e的弱 | |
| B. | 元素c的最高价氧化物对应水化物的碱性比d的强 | |
| C. | 简单离子半径r:c>d>e>b | |
| D. | 元素a、b、e各自最高和最低化合价的代数和分别为0、4、4 |
 4-甲基-3-乙基-2-己烯;
4-甲基-3-乙基-2-己烯;  2,2,3-三甲基戊烷;
2,2,3-三甲基戊烷; 1,4-二乙基苯.
1,4-二乙基苯. .
. 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: