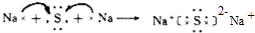题目内容
X,Y,Z,M,N均为氮的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下转化关系(未配平),这五种化合物中氮的化合价由高到低的顺序是________.
①X+M→Y
②N Z+O2↑
Z+O2↑
③M+Y+NaOH→Z+H2O
④M+NaOH→Z+N+H2O
答案:N>M>Z>Y>X
解析:
提示:
解析:
|
【答案】N>M>Z>Y>X 【解析】此题考查的知识点是在氧化还原反应中,化合价一定既有升高又有降低.突破口为反应②,N为氮的含氧化合物,O(-2价)→O2化合价升高,所以氮的化合价只能降低,N中氮的化合价比Z高.再分析反应④,Z,M,N均为氮的含氧化合物,且此反应只能是氮元素的化合价发生变化,这是一个歧化反应,M中氮的化合价应介于Z,N两者之间.既然N中氮的化合价比Z高,所以氮的化合价应N>M>Z.再分析反应③,也只能是氮的化合价发生变化,这是一个归中反应,Z中氮的化合价应介于M,Y之间,所以M>Z>Y.最后分析反应①,同理得出M>Y>X. |
提示:
|
【发现规律】歧化反应如M+NaOH→Z+N+H2O,化合价发生变化的元素的化合价M应介于Z,N两者之间,而归中反应如X+M→Y,化合价发生变化的元素的化合价Y应介于X和M之间. |

练习册系列答案
相关题目