题目内容
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s)![]() N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min n(NO)/mol T | 0 | 40 | 80 | 120 | 160 | |
甲 | T℃ | 2 | 1.45 | 1 | 1 | 1 |
乙 | 400℃ | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
丙 | 400℃ | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
①甲容器反应温度T℃__400℃(填“>”或“<”或“=”);
②乙容器中,0~40min内平均反应速率v(N2)=__;
③丙容器中达平衡后NO的转化率为__。
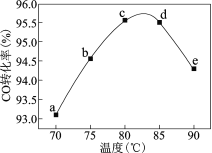
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B、C三点中NO2的转化率最高的是__点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=__MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为__。
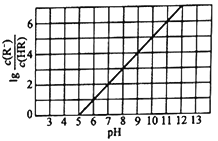
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4,则用氨水将SO2转化为NH4HSO3的离子方程式为__;实验测得NH4HSO3溶液中![]() =15,则溶液的pH为__。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=15,则溶液的pH为__。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
【答案】> 6.25×10-3mol·L-1min-1 60% A 4 2H2(g)+SO2(g)=S(g)+2H2O(g) △H=+90.4kJ/mol NH3H2O+SO2=![]() +
+![]() 5
5
【解析】
对于一个化学反应,温度越高,反应速率越快,达平衡的时间越短;在同一反应中,由一种物质的物质的量的变化量求另一物质表示的反应速率时,可借助化学方程式,利用化学计量数之比等于物质的量的变化量之比进行求解;在一个可逆反应中,反应物的转化率等于其变化量与起始量之比;对于一个气体分子数增大的可逆反应,压强越高,反应物的平衡转化率越小;求解平衡常数时,可利用三段式求平衡时各物质的浓度,然后求压强分数,最后求压强平衡常数;利用盖斯定律,可利用已知反应求出未知反应的热化学方程式;在NH4HSO3溶液中,电离与水解同时存在,可建立![]() 电离与水解方程式,从而求出氢离子浓度,最终求出pH。
电离与水解方程式,从而求出氢离子浓度,最终求出pH。
(1)①比较表中甲与乙中达平衡的时间,甲容器先达平衡,所以反应温度T℃>400℃;
②乙容器中,0~40min内,NO的物质的量的变化量为0.5mol,则N2的物质的量为0.25mol,平均反应速率v(N2)= = 6.25×10-3mol·L-1min-1;
= 6.25×10-3mol·L-1min-1;
③因为反应前后气体的分子数相等,所以压强改变时平衡不发生移动,丙容器中达平衡后NO的转化率与乙容器相同,都为![]() =60%。答案为:>;6.25×10-3mol·L-1min-1;60%;
=60%。答案为:>;6.25×10-3mol·L-1min-1;60%;
(2)①因为反应物的气体分子数小于生成物的气体分子数,增大压强,平衡逆向移动,压强小时,反应物的转化率高,所以A、B、C三点中NO2的转化率最高的是A点。
②设平衡时,参加反应的NO2的物质的量为x,则可建立如下三段式:
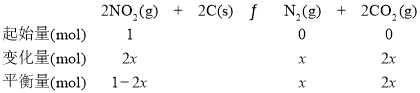
依题意得,1-2x=2x,x=0.25mol,KP=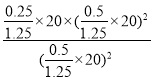 =4。答案为:A;4;
=4。答案为:A;4;
(3) 方法①:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0kJ·mol-1 ①
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1 ②
2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ·mol-1 ③
利用盖斯定律,将①-②+③得,2H2(g)+SO2(g)=S(g)+2H2O(g) △H=+90.4kJ/mol。
方法②:用氨水将SO2转化为NH4HSO3的离子方程式为NH3H2O+SO2=![]() +
+![]() ;
;
![]()
![]() H++
H++![]() Ka2=
Ka2=![]() =1.0×10-7,
=1.0×10-7,
![]() +H2O
+H2O![]() H2SO3+OH- Kh=
H2SO3+OH- Kh=![]() =
=![]() =
=![]()
所以![]() =
=![]() =
=![]() =1.0×10-7×1.5×10-2,c(H+)=1.0×10-5mol/L,则溶液的pH为5。答案为:2H2(g)+SO2(g)=S(g)+2H2O(g) △H=+90.4kJ/mol;NH3H2O+SO2=
=1.0×10-7×1.5×10-2,c(H+)=1.0×10-5mol/L,则溶液的pH为5。答案为:2H2(g)+SO2(g)=S(g)+2H2O(g) △H=+90.4kJ/mol;NH3H2O+SO2=![]() +
+![]() ;5。
;5。