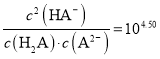题目内容
【题目】常温下,向![]() 的某二元弱酸
的某二元弱酸![]() 溶液中逐滴加入NaOH溶液,
溶液中逐滴加入NaOH溶液,![]() A、
A、![]() 、
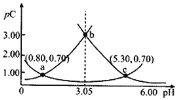
、![]() 的物质的量分数随pH的变化如图所示。下列叙述正确的是
的物质的量分数随pH的变化如图所示。下列叙述正确的是

A.将等物质的量的NaHA和![]() 混合物溶于水,所得溶液中
混合物溶于水,所得溶液中![]()
B.![]() 时,溶液中微粒浓度的大小关系为:
时,溶液中微粒浓度的大小关系为:![]()
C.M点时,![]()
![]()
D.已知KHA难溶于水,若用![]() 沉淀
沉淀![]() ,溶液pH在
,溶液pH在![]() 之间为最佳
之间为最佳
【答案】D
【解析】
由图可知,pH=1.0时,几乎全为H2A,随pH的增大,H2A逐渐减少,HA-逐渐增加,pH=3.04时,c(H2A)= c(HA-),![]() =c(H+)=10-3.04;pH=4时,c(HA-)达到最大;c(A2-)也逐渐增加,pH接近4时,c(H2A)= c(A2-); pH=4.87时,c(HA-)= c(A2-),
=c(H+)=10-3.04;pH=4时,c(HA-)达到最大;c(A2-)也逐渐增加,pH接近4时,c(H2A)= c(A2-); pH=4.87时,c(HA-)= c(A2-),![]() =c(H+)=10-4.87;Ka1
=c(H+)=10-4.87;Ka1![]() 2=10-3.04×10-4.87=10-7.91>10-14,所以HA-电离>水解,NaHR溶液显酸性。根据以上认识,结合其它电解质溶液知识可解答各小题。
2=10-3.04×10-4.87=10-7.91>10-14,所以HA-电离>水解,NaHR溶液显酸性。根据以上认识,结合其它电解质溶液知识可解答各小题。
![]() 将等物质的量的NaHA和
将等物质的量的NaHA和![]() 混合物溶于水:根据分析,Ka2=10-4.87>10-7,所以HA-的电离> A2-的水解,溶液中存在c(HA-)< c(A2-),故A错误;
混合物溶于水:根据分析,Ka2=10-4.87>10-7,所以HA-的电离> A2-的水解,溶液中存在c(HA-)< c(A2-),故A错误;
B. 根据图知,![]() 时,
时,![]() ,溶液中溶质主要为NaHA、
,溶液中溶质主要为NaHA、![]() 为二元弱酸,电离程度较小,所以溶液中存在
为二元弱酸,电离程度较小,所以溶液中存在![]() ,故B错误;
,故B错误;
C. M点溶液中溶液体积增大导致其浓度降低,所以M点溶液中存在![]()
![]() ,故C错误;
,故C错误;
D. KHA难溶于水,若用![]() 沉淀
沉淀![]() ,根据图知,要使
,根据图知,要使![]() 最大而
最大而![]() 、
、![]() 浓度较小,所以溶液pH在
浓度较小,所以溶液pH在![]() 之间为最佳,故D正确;
之间为最佳,故D正确;
答案选D。

 手拉手全优练考卷系列答案
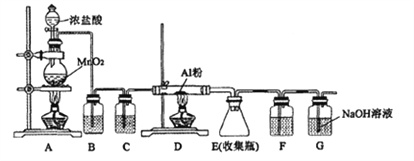
手拉手全优练考卷系列答案【题目】Ⅰ.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=span>_____,通过实验_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是______________________;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为__________。
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式_______________。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
Ⅱ.(1)用大苏打(硫代硫酸钠)和硫酸溶液发生反应时溶液变浑浊的时间,也可研究外界条件对化学反应速率的影响。写出相应反应的化学方程式_______。
(2)已知大苏打溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是__________。